Этиленгликоль
ЭТИЛЕНГЛИКОЛЬ (1,2-этандиол) НОСН2СН2ОН, мол. м. 62,07; бесцв. вязкая гигроскопич. жидкость без запаха, сладковатого вкуса; т. пл.-12,7 °С, т. кип. 197,6 °С, 100°С/16 мм рт. ст.;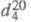 1,1088;
1,1088;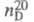 1,4316;
1,4316;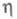 19,83 мПа х с (20 °С);
19,83 мПа х с (20 °С);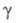 48,4 мН/м (20 °С);
48,4 мН/м (20 °С);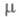 7,3 х 10-30 Кл-м (30 °С); х ур-ние температурной зависимости давления пара в интервале 25-90 °С: lgp (мм рт. ст.) = 8,863 - 2694,7/t;
7,3 х 10-30 Кл-м (30 °С); х ур-ние температурной зависимости давления пара в интервале 25-90 °С: lgp (мм рт. ст.) = 8,863 - 2694,7/t;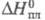 11,64 Дж/моль;
11,64 Дж/моль;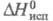 58,71 Дж/моль;
58,71 Дж/моль;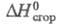 жидкости -1180,3 Дж/моль (20 °С);
жидкости -1180,3 Дж/моль (20 °С);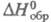 газа -397,75 кДж/моль; теплопроводность 0,29 Вт/(м х град), электропроводность 1,07 х 10-6 См х см-1,
газа -397,75 кДж/моль; теплопроводность 0,29 Вт/(м х град), электропроводность 1,07 х 10-6 См х см-1,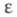 38,66 (20 °С). Хорошо раств. в воде, спиртах, кетонах и др., умеренно - в бензоле, толуоле, диэтиловом эфире, ССl4. В этиленгликоле плохо раств. растит. и животные масла и не раств. минер. масла, парафины, каучук, ацетил- и этил-целлюлоза, поливинилхлорид.
38,66 (20 °С). Хорошо раств. в воде, спиртах, кетонах и др., умеренно - в бензоле, толуоле, диэтиловом эфире, ССl4. В этиленгликоле плохо раств. растит. и животные масла и не раств. минер. масла, парафины, каучук, ацетил- и этил-целлюлоза, поливинилхлорид.
При растворении этиленгликоля в воде выделяется теплота и происходит уменьшение объема. Водные р-ры замерзают при низких т-рах:
Концентрация этиленгликоля , % по объему 20 30 40 50 66,7 80 90 Т-ра замерзания, °С -8 -15 -24 -36 -75 -47 -29. Этиленгликоль обладает всеми св-вами гликолей. С щелочными металлами и щелочами образует гликоляты, с орг. к-тами или их ангидридами - одно- и двухзамещенные сложные эфиры, с HHal - этиленгалогенгидрины НОСН2СН2На1, с РС15 - дихлорэтан С1СН2СН2С1, с акрилонитрилом - моно- и ди(2-цианоэтиловые) эфиры этиленгликоля, соотв. HOCH2CH2OCH2CH2CN и [CH2(OCH2CH2CN)]2, при дегидратации - ацетальдегид (в присут. ZnCl2), диэтиленгликоль (в присут. NaOH) или диоксан (при нагр. в присут. H2SO4), с этиленоксидом - полиэтиленгликоли Н(ОСН2СН2)nОН. При окислении этиленгликоля в зависимости от условий и окислителя образуется смесь гликолевого альдегида НОСН2СНО, гликолевой к-ты НОСН2СООН, глиоксаля ОНССНО, глиоксалевой к-ты ОНССООН и щавелевой к-ты; окисление мол. кислородом приводит к пероксидам, формальдегиду, муравьиной к-те. КМnО4 и К2Сr2О7 окисляют этиленгликоль до СО2 и Н2О.
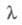 275 нм должно составлять не менее 95-97%).
275 нм должно составлять не менее 95-97%). Первое пром. произ-во этиленгликоля основывалось на гидролизе дихлорэтана водным р-ром соды при 200 °С и давлении 10 МПа:
С1СН2СН2С1 + Na2CO3 + Н2О НОСН2СН2ОН + 2NaCl + СО2
НОСН2СН2ОН + 2NaCl + СО2
. Этиленгликоль может быть получен взаимод. этиленоксида с СО2 при т-ре 80-120 °С и давлении 2-5 МПа в присут. галогенидов щелочных металлов, аммония или аминов с послед. гидратацией образующегося этиленкарбоната:
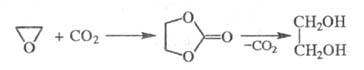
Этот метод позволяет использовать водный р-р этиленоксида (1:1), выход 97-98%.
Этиленгликоль образуется также при ацетоксилировании этилена с послед. гидролизом моно- и диацетатов этиленгликоля (кат.- хлориды Pd, Li, нитраты Fe, Ni); недостаток метода - высокая коррозионность среды, трудность отделения солей и продуктов р-ции, необходимость регенерации катализатора.
При уменьшении добычи нефти и резком увеличении стоимости этилена представляют интерес методы синтеза этиленгликоля из альтернативного сырья: синтез-газа, метанола, СО и воды при т-ре 200 °С и давлении 70 МПа либо в жидкой фазе при 40 МПа в присут. оксидных медно-магниевых или родиевых катализаторов; из СО и Н2 - через диэфиры щавелевой к-ты.
Этиленгликоль применяют в хим., текстильной, автомобильной, авиационной, электротехн. пром-сти; 41-45% мирового произ-ва этиленгликоля используется для получения синтетич. полиэфирных волокон и пленок, ~ 40% - в произ-ве антифризов. Этиленгликоль применяют также в произ-ве гидравлич. и закалочных жидкостей, полиуретанов, алкидных смол и др.
Этиленгликоль токсичен при попадании внутрь, действует на центр. нервную систему и почки; смертельная доза 1,4 г/кг. ПДК в воздухе рабочей зоны 5 мг/м3.
Этиленгликоль- горючая жидкость. Т. всп. в открытом тигле 120 °С, т. самовоспл. 380 °С, КПВ в воздухе: нижний 3,8, верхний 6,4% (по объему). Температурные пределы воспламенения: нижний 112 °С, верхний 124 °С.
Мировое потребление этиленгликоля ~ 8 млн. т в год (1992).
Лит.: Дымент О.Н., Казанский К. С., Мирошников A.M., Гликоли и другие производные окисей этилена и пропилена, М., 1976; Kirk-Othmer encyclopedia, 3 ed., v. 9, N. Y., 1980.
Б. Б. Чесноков.
