Толуол
ТОЛУОЛ (метилбензол) С6Н5СН3, мол. м. 92,14; бесцв. жидкость с ароматич. запахом; т. пл. — 94,99 °С, т. кип. 110,62 °С; 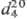 0,8669;
0,8669; 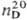 1,49693; tкрит 318,64 °С, pкрит 4,109 МПа; h 0,584 мПа· с (20 °С); g 28,5 мН/м (20 °С); ур-ние температурной зависимости давления пара: Igp (МПа) = 3,075 - 1343,94(t + 219,38);
1,49693; tкрит 318,64 °С, pкрит 4,109 МПа; h 0,584 мПа· с (20 °С); g 28,5 мН/м (20 °С); ур-ние температурной зависимости давления пара: Igp (МПа) = 3,075 - 1343,94(t + 219,38);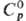 0,1049 кДж/(моль·К);
0,1049 кДж/(моль·К); 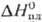 6,62 кДж/моль,
6,62 кДж/моль, 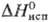 37,99 кДж/моль,
37,99 кДж/моль,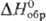 —12 кДж/моль,
—12 кДж/моль, 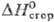 — 3916 кДж/моль,
— 3916 кДж/моль, 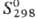 (газ) 319,7 Дж/(моль·К). Смешивается со спиртами, углеводородами, хорошо раств. в большинстве орг. р-рителей; р-римость в воде 0,014% по массе (20 °С); р-римость воды в толуоле 0,4% (20 °С). Образует азеотропные смеси: с водой (86,5% толуола по массе, т. кип. 84,1°С), метанолом (31% толуола, 63,8 °С), уксусной к-той (72,5% толуола, 100,6 °С) и др.
(газ) 319,7 Дж/(моль·К). Смешивается со спиртами, углеводородами, хорошо раств. в большинстве орг. р-рителей; р-римость в воде 0,014% по массе (20 °С); р-римость воды в толуоле 0,4% (20 °С). Образует азеотропные смеси: с водой (86,5% толуола по массе, т. кип. 84,1°С), метанолом (31% толуола, 63,8 °С), уксусной к-той (72,5% толуола, 100,6 °С) и др.
По хим. св-вам толуол-типичный представитель ароматич. углеводородов. Легко образует комплексы с переносом заряда: с переходными металлами (Со, Мо и др.) комплексы "сэндвичевого" типа, с трикарбонилхромом-"зонтичного" типа, а также со мн. орг. акцепторами электронов (тринитробензол и др.). В р-ции электроф. замещения (нитрование, галогенирование, сульфирование и др.) вступает легче бензола, образуя моно-, ди- и три-замещенные, гл. обр. по пара- и орто-положениям. При окислении по метильной группе в зависимости от условий осн. продукты р-ции -бензиловый спирт (окислитель -О2), бензальдегид (Сr2О3) или бензойная к-та (О2, Вr2, бензоаты Со и Мn). При галогенировании в боковую цепь под действием УФ облучения превращ. в смесь бензилхлорида, a,a-дихлортолуола (бензальхлорид) и (трихлорметил)бензо-ла (бензотрихлорид); процесс сопровождается хлорированием в ядро. Гидрирование толуола на цеолитных и оксидных (Сr2О3, МоО3, СоО) катализаторах при высоких т-рах (600-800 °С, давление 3,5-6 МПа) приводит к бензолу (пром. метод, до 2 млн. т/год в США), гидрирование в присут. Ni, Pt и др. в жидкой (10-30 МПа, 100-200 °С) или газовой (0,1 МПа, 110-180°С) фазе-к метилцикло-гексану.
Получают толуол преим. из нефти при вторичной ее переработке: риформинге низкокипящих продуктов, полученных при прямой перегонке нефти или каталитич. крекинге, пиролизе газойля и рафинатов риформинга, направленном одновременно на получение непредельных и ароматич. углеводородов. Очистку нефтяного толуола осуществляют методом экстракции (экстрагейты ди- и триэтиленглико-ли, N-метилпирролидон, ДМФА) или экстрактивной ректификации.
Каменноугольный толуол, образующийся в процессе коксования, извлекают из коксового газа в виде компонента сырого бензола, подвергают сернокислотной очистке (для удаления непредельных и серосодержащих соед.) и выделяют ректификацией. Чистоту и качество толуола контролируют методами ГЖХ. Значит. кол-во толуола получают как побочный продукт при синтезе стирола из бензола и этилена.
Осн. кол-во толуола перерабатывают в бензол, фенол, капро-лактам, толуилендиизоцианаты; остальное кол-во используют в качестве р-рителя для пластич. масс, нитроцеллю-лозных, алкидных лаков и эмалей, высокооктанового компонента моторных топлив, исходного в-ва для получения многочисл. производных (в т.ч. галоген-, сульфо-и нитропроизводных).
Толуол легко воспламеняется, т. всп. 4 °С, т. самовоспл. 536 °С, КПВ 1,25-6,7% по объему. Поражает человека через органы дыхания и кожу, вызывает нервное возбуждение, рвоту, при больших концентрациях-потерю сознания; ПДК 0,6 мг/м3, ПДК в воде 0,05 мг/л.
Объем произ-ва толуола в мире-десятки млн. т в год. В США в продуктах риформинга содержится более 30 млн. т толуола (1982), однако его осн. часть (~90%) не выделяется, а используется в качестве высокооктанового компонента моторных топлив. Произ-во толуола в виде индивидуального соед. в 1981 в мире составило 5,5 млн. т.
Толуол получен впервые П. Пельтье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь к-рого получил свое название.
Лит.: Соколов В.З., Харлампович Г. Д., Производство и использование ароматических углеводородов, М., 1980; Toluene, the xylenes and their industrial derivatives, Chemical engineering monographs, v. 15, Amst, 1982; Kirk-Othmer encyclopedia, 3 ed., v. 23, N.Y., 1983, p. 246-73. В.Л. Збарский.
