Сульфирование
СУЛЬФИРОВАНИЕ (сульфонирование), введение сульфо-группы SO2OH в молекулу орг. соединения; в широком смысле сульфирование-введение группы SO2X (X = ОН, ONa, OAlk, OAr, Hal, NAlk2 и т.п.). О введении группы SO3H с образованием связей О—S (О-сульфирование, сульфатиро-вание, сульфоэтерификация) см. Сульфаты органические.
Процесс, обратный сульфированию (удаление группы SO2X из молекулы орг. соединения), наз. десульфированием (десульфо-нированием). Сульфирование осуществляют прямым путем с использованием сульфирующих агентов либо косвенным путем, напр. введением сульфогруппы в составе сульфоалкильных фрагментов (СН2)nSО2Х. Сульфирующие агенты: H2SO4, SO3 и его комплексы с орг. соединениями (эфирами, третичными аминами и фосфинами, амидами карбоновых кислот, три-алкилфосфатами и др.), олеум, SOCl2, галогенсульфо-нрвые и сульфаминовые к-ты, диалкилсульфаты, ацил-сульфаты.
Сульфирование ароматич. углеводородов протекает по механизму электроф. замещения:
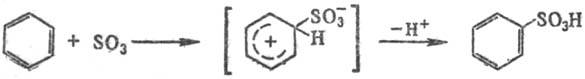
Р-пию осуществляют как в паровой, так и в жидкой фазе (р-рители: SO2, СС14, хладоны и т. п.). При сульфировании серной к-той для смещения равновесия вправо применяют избыток к-ты или связывают воду добавлением олеума, азеотропной отгонкой и т.п.
Соед. с электронодонорными заместителями более реак-ционноспособны и сульфируются преим. в орто- и пара-положения; соед. с электроноакцепторными заместителями-в мета-положение. В большинстве случаев при сульфировании замещенных бензолов образуются смеси изомеров, соотношение к-рых зависит от природы заместителя, сульфирующего реагента и условий р-ций (концентрации реагентов, т-ры, р-рителя, наличия катализаторов и т.д.). Путем подбора оптим. условий возможно селективное сульфирование. Так, сульфирование толуола серной к-той при 20 °С приводит к равным кол-вам о- и n-толуолсульфокислот, а при, использовании SO3 в тех же условиях - исключительно к n-изомеру; при сульфировании фенола на холоду преим. образуется о-фгнолсульфокислота, тогда как при 100°С-n-фенолсульфокислота. Как правило, подобные различия обусловлены превращением одних изомеров в другие, термодинамически более стабильные, благодаря изомеризации или обратимости сульфирования. Напр., нафталин при температурах ниже 100°С первоначально образует a-нафталинсульфокислоту, к-рая во времени превращ. в b-изо-мер в результате последовательного десульфирования-ресульфирования. Сульфирование при 160°С приводит исключительно к b-нафталинсульфокислоте (см. Нафталинсульфо-кислоты).
Для сульфирования гетероциклич. соединений (фуран, пиррол, тиофен, индол и др.) используют комплексы SO3 с диоксаном или пиридином. Эти же реагенты применяют для сульфирования алифатич. соед., содержащих сильные электроноакцепторные группы; при этом образуются, как правило, a-сульфопроизводные:
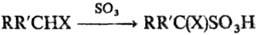
X = СНО, COR:, COOH, CN, NO2, SO3H и др.
Повышение СН-кислотности алифатич. соединений способствует тому, что последующее сульфирование протекает более однозначно, чем моносульфирование. Напр., ацетальдегид и уксусная к-та с высоким выходом образуют соответствующие да- и трисульфосоединения:
СН3СНО + 2SO3·Диоксан : (HSO3)2CHCHO
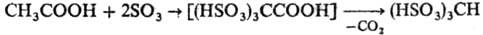
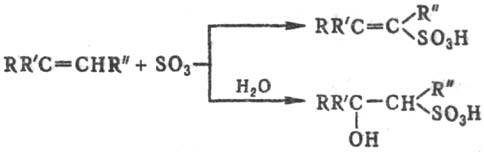
Легко реагируют с SO3 и его комплексами алкены, которые образуют в зависимости от структуры и условий b- или d-сультоны (см. Сулътоны) либо a,b- или b,g-ненасыщ. сульфокислоты, а также b-гидроксисульфокис-лоты, напр.:
Прямое сульфирование алканов протекает с трудом и сопровождается, как правило, окислением. Подобные р-ции редко используют для препаративных целей, но находят им практич. применение для сульфирования полимеров, напр. полиэтилена, с целью их модификации. Значительно легче сульфируются углеводороды при совместном действии SO2 и О2 (сульфо-окисление), а также SO2 и Сl2 (сульфохлорирование). Обе р-ции имеют радикальный характер и инициируются пе-роксидами, УФ или g-облучением:
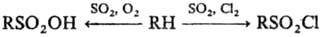
Эти процессы имеют важное значение в пром. произ-ве ПАВ.
Для сульфирования орг. соединений широко используют H2SO3 и ее производные. Гидросульфиты присоединяются к альдегидам и кетонам (р-ция 1), а также в условиях радикального инициирования к алкенам и алкинам (2,3); взаимод. с трифенил- и три(n-толил)карбинолами (4); реагируют с оксиранами, тииранами с раскрытием кольца (5):
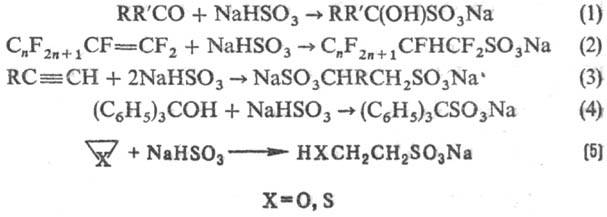
Диазоалканы сульфируют SO2 в присутствии воды, спиртов, тиолов и аминов (6), последоват. действие SO2 и галогена на реактивы Гриньяра приводит к сульфонил-галогенидам (7):
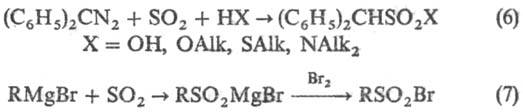
К косвенным методам сульфирования относят сульфометилирование, сульфоэтилирование и т.д., напр.:
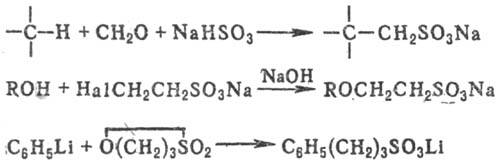
Сульфирование используют при получении ПАВ, ионообменных мембран и смол, биологически активных в-в, красителей и др.
Лит.: Джильберт Э. Е., Сульфирование органических соединений, пер. с англ., М., 1969; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 508-53. А. Ф. Ермолов.
