Десульфирование
ДЕСУЛЬФИРОВАНИЕ, удаление сульфогруппы SO3H из молекулы орг. соединения. Осуществляется заменой группы SO3H на атом Н или др. группу. Десульфирование алифатич. соед., содержащих SO3H-гpyппy при насыщенном атоме С, происходит лишь в жестких условиях, напр., при нагр. с водным р-ром NaOH при 250-300 °С: RSO3H + 2NaOH : ROH + Na2SO3 + H2O. Группа SO3H, связанная с ароматич. кольцом, более подвижна, что используется для ее замещения на атом Н или др. функц. группу. Так, обработка ароматич. сульфокислот перегретым водяным паром в присут. H2SO4 или Н3РО4 при т-ре до 250 °С легко приводит к продуктам десульфирования, напр.: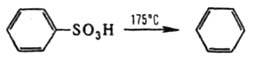
Электроноакцепторные заместители в ароматич. ядре затрудняют десульфирование, электронодонорные, находящиеся в орто- или пара-положении, - существенно облегчают. При этом, напр., десульфирование легко осуществляется под действием HNO3:
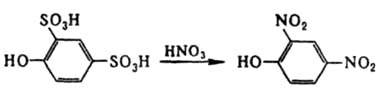
Десульфирование широко используют для разделения изомеров сулъфокислот. Напр., о-, м- и n-толуолсульфокислоты десульфируются соотв. при т-рах 158, 188 и 156°С, что дает возможность выделить мета-изомер. Ароматич. сульфокислоты, содержащие в орто- или пара-положении электронодонорные группы (NH2 или ОН), при галогенировании в щелочной среде обычно подвергаются десульфированию, напр.:
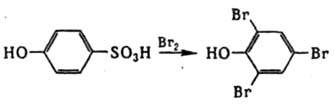
Нагревание ароматич. сульфокислот с KCN приводит к нитрилам, сплавление с NaOH (или КОН) - к фенолам. В нек-рых случаях десульфирование достигается восстановлением SО3Н-группы (электролитически, действием амальгамы Na при 20 °С или Zn в присут. NaOH, а также перегонкой сульфокислот либо их аммониевых и свинцовых солей в смеси с NH4Cl). Лит.. Оаэ Сигэру, Химия органических соединений серы, пер. с япон., М., 1975; Мищенко Г Л., Вацуро К В.. Синтетические методы органической химии, М., 1982. А. Б. Пономарев.
Ещё по теме
Сульфирование органических соединений
Сульфирование органических соединений
Десорбция — основные принципы и применение
Сублимация и десублимация — механизмы и применение в химической технологии
Процессы дезалкилирования, дезаминирования и десульфирования
Дегидратация в химии — процессы и примеры
Органические сульфаты — свойства и применение
Методы получения олефинов
Штоббе конденсация — механизм и применение в органическом синтезе
Сульфокислоты — строение, свойства и применение
Сульфоны — свойства, получение и применение
