Фуран
ФУРАН, мол. м. 68,075; бесцв. жидкость с запахом, напоминающим хлороформ; т. пл. -85,6 0C; т. кип. 31,83 0C;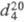 0,937;
0,937; 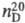 1,4214; ур-ния температурной зависимости давления пара: lg p = 8,4768 - 1671,4/Т (198-259 К); lg p = 7,6506-1457,7/T(276-366 К);ркрит 5,15 МПа; tкрит 214 0C; dкрит 0,312 г/см3; h 3,8 мП·с (20 0C); g 24,1 мН/м (20 0C);
1,4214; ур-ния температурной зависимости давления пара: lg p = 8,4768 - 1671,4/Т (198-259 К); lg p = 7,6506-1457,7/T(276-366 К);ркрит 5,15 МПа; tкрит 214 0C; dкрит 0,312 г/см3; h 3,8 мП·с (20 0C); g 24,1 мН/м (20 0C); 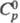 59,44 Дж/(моль·К);
59,44 Дж/(моль·К); 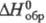 -62,37 кДж/моль;
-62,37 кДж/моль; 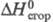 -2,08 МДж/моль;
-2,08 МДж/моль; 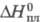 3,8 кДж/моль;
3,8 кДж/моль; 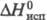 27,2 кДж/моль;
27,2 кДж/моль; 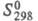 261,8 Дж/(моль·К); m 0,2397·10-30 Кл·м; e 2,95 (20 0C). Смешивается во всех отношениях с ацетоном, бензолом, CHCl3 и др. орг. р-рителями, слабо раств. в воде (при 25 0C в 100 г воды раств. 1 г фурана); в 100 г фурана раств. 0,3 г воды. Образует азеотропные смеси с водой (98,8% фурана по массе, т. кип. 30,5 0C) и 2-метилбутаном (92% фурана, т. кип. 27,95 0C). Устойчив к действию щелочей, разлагается к-тами.
261,8 Дж/(моль·К); m 0,2397·10-30 Кл·м; e 2,95 (20 0C). Смешивается во всех отношениях с ацетоном, бензолом, CHCl3 и др. орг. р-рителями, слабо раств. в воде (при 25 0C в 100 г воды раств. 1 г фурана); в 100 г фурана раств. 0,3 г воды. Образует азеотропные смеси с водой (98,8% фурана по массе, т. кип. 30,5 0C) и 2-метилбутаном (92% фурана, т. кип. 27,95 0C). Устойчив к действию щелочей, разлагается к-тами.
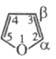
Фуран - гетероароматич. соед., св-ва к-рого определяются наличием кольцевого секстета p-электронов, образованных 4 p-электронами двух связей С = С и неподеленной электронной пары гетероатома; другая неподеленная пара электронов атома кислорода остается свободной и может участвовать в образовании оксониевых соединений. Для фурана характерны р-ции электроф. замещения: галогенирование, нитрование, сульфирование, ацилирование, меркурирование и др.; причем низкая устойчивость цикла требует проведения этих р-ций в "мягких" условиях, напр.:
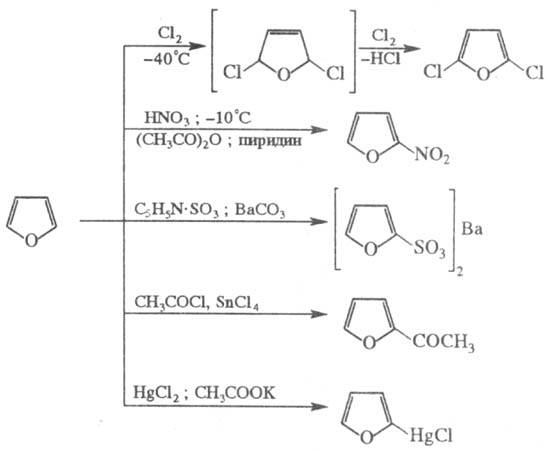
Введение электроноакцепторных заместителей повышает устойчивость ядра фурана; так, напр., 2-фуранкарбоновая (пиросли-зевая) к-та (т. пл. 133 0C, т. кип. 230 С, 141-144/20 мм рт. ст.) легко нитруется конц. HNO3 в соответствующее 5-нитропро-изводное, в то время как фуран в этих условиях разрушается. Р-ция фурана с бромцианом приводит к смеси 2-бром- и 2-циано-фуранов, формилирование - к фурфуролу, озонирование - к смеси глиоксаля и формальдегида, окисление H2O2 в присут. катализатора Os2O8 - к малеиновому ангидриду.
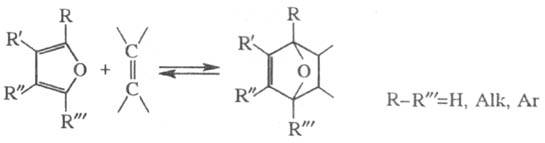
Фуран проявляет также св-ва диена и может участвовать в диеновом синтезе, напр.:
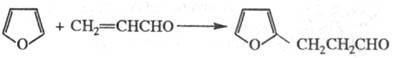
В случае менее активных диенофилов, напр. акролеина, имеет место заместительное присоединение:
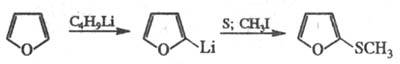
Фуран и многие его замещенные легко вступают в р-ции металлирования, что используют в препаративных целях, напр, для синтеза сульфидов:
Гидрирование фурана над Ni-Ренея (100-160 0C, 16 МПа) приводит к тетрагидрофурану. При более высоких т-рах происходит гидрогенолиз фуранового кольца. При действии H2S или NH3 (450-500 0C, Al2O3) фуран превращается в тиофен или пиррол (р-ция Юрьева).
Фуран вместе с 2-метилфураном (сильваном) содержится в продуктах сухой перегонки нек-рых пород древесины.
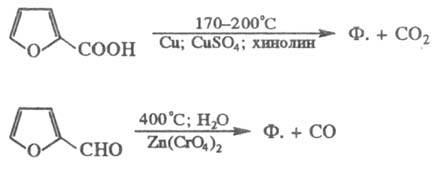
В лаборатории фуран обычно получают декарбоксилировани-ем пирослизевой к-ты, в пром-сти - декарбонилированием фурфурола:
Фуран применяют для получения ТГФ, тиофена, пиррола, селенофена и малеинового ангидрида, а также в качестве р-рителя и экстрагента масел и жиров. Производные фурана используют как лек. средства (см. Фурадонин, Фуросемид)и средства защиты растений.
Фуран проникает через неповрежденную кожу, поражает центр. нервную систему, печень. ЛД50 при ингаляции ок. 3000 мг/м3 (мыши, 2 ч), ПДК 0,5 мг/м3; ПДК в воде 0,2 мг/л. T. всп. -50 0C; т. самовоспл. 510 0C; КПВ 1,2-8,0% по объему; ниж. температурный предел взрываемости -50 0C, верхний
Лит.: Иванский В.И., Химия гетероциклических соединений, M., 1978; Общая органическая химия, пер. с англ., т. 9, M., 1985, с. 117-78; Dunlop A.P., Peters F.N., The Furans, N. Y., 1953.
С. К. Смирнов, С. С. Смирнов.
