Уран
УРАН (лат. Uranium) U, радиоактивный хим. элемент III гр. периодич. системы, ат. н. 92, ат. м. 238,0289; относится к ак-тиноидам. Стабильных изотопов не имеет. Известно 16 изотопов с мас. ч. 226-240, 242; наиб. долгоживущие изотопы 234U (Т1/2 2,45·105 лет, a-излучатель), 235U (T1/2 7,04·108 лет, a-излучатель) - родоначальник радиоактивного ряда (4n + 3) и 238U (Т1/24,47·109 лет, a -излучатель)- родоначальник радиоактивного ряда (4n + 2). Прир. смесь изотопов содержит 99,275% 238U, 0,720% 235U, 0,005% 234U. Поперечное сечение захвата тепловых нейтронов 233U 4,6·10-27 м2, 235U 9,8 · 10-27 м2, 238U 2,7 · 10-28 м2; сечение деления 233U 5,27·10-26 м2, 235U 5,84·10-26 м2, прир. смеси изотопов 4,2·10-28 м2. Конфигурация внеш. электронных оболочек атома 5f36s26p66d17s2>r; степени окисления +2, +3, +4, +5, +6 (наиб. устойчивая); электроотрицательность по Полингу 1,22; ат. радиус 0,156 нм, ионные радиусы U3+ 0,1024 нм, U4+ 0,089 нм, U5+ 0,088 нм и U6+ 0,083 нм.
Среднее содержание U в земной коре 3 · 10-4% по массе. В слое литосферы толщиной 20 км содержится ~ 1014 т, в морской воде 109-1010 т. Важнейшие минералы: настуран U3O8 уранинит (U, Th)O2, урановая смоляная руда (оксиды UO2,0-UO2,67), карнотит K2[(UO2)2(VO4)2]·3H2O, тюямунит Ca[(UO2)2(VO4)2]·8H2O. Пром. значение имеют также тита-наты, напр. браннерит UTi2O6, силикаты - коффинит U[SiO4]1-x(OH)4x, танталониобаты и гидритированные фосфаты и арсенаты уранила - урановые слюдки. Крупные месторождения урана находятся в Канаде, ЮАР, США, Австралии, Франции и др. странах.
Свойства. Уран- серебристо-белый блестящий металл. Ниже 669 0C устойчива a-форма с ромбич. решеткой, а = 0,2854 нм, b = 0,5869 нм, с =0,4956 нм, z = 4, пространств. группа Cmcm, плотн. 19,12 г/см3; в интервале 669-776 0C устойчива 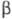 -форма с тетрагон, решеткой, а =1,0758 нм, с = 0,5656 нм, z = 30, пространств, группа P42/mnm, плотн. 18,11 г/см3; выше 776 0C существует
-форма с тетрагон, решеткой, а =1,0758 нм, с = 0,5656 нм, z = 30, пространств, группа P42/mnm, плотн. 18,11 г/см3; выше 776 0C существует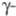 форма с объемноцентрированной кубич. решеткой, а = 0,3525 нм, z = 2, пространств. группа Im3m, плотн. 18,06 г/см3;
форма с объемноцентрированной кубич. решеткой, а = 0,3525 нм, z = 2, пространств. группа Im3m, плотн. 18,06 г/см3; 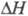 перехода
перехода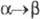 2,78 кДж/моль,
2,78 кДж/моль, 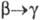 4,73 кДж/моль. T. пл. 1135 С, т. кип. ок. 4200 0C; рентгеновская плотн.
4,73 кДж/моль. T. пл. 1135 С, т. кип. ок. 4200 0C; рентгеновская плотн. 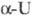 19,16 г/см3; С°p 27,67 Дж/(моль·К);
19,16 г/см3; С°p 27,67 Дж/(моль·К); 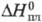 8,72 кДж/моль,
8,72 кДж/моль,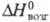 446,7 кДж/моль; S0298 50,20 Дж/(моль·К); ур-ние температурной зависимости давления пара lgp (мм рт. ст.)= = -25230/Г+5,71 (1980-2420 К);
446,7 кДж/моль; S0298 50,20 Дж/(моль·К); ур-ние температурной зависимости давления пара lgp (мм рт. ст.)= = -25230/Г+5,71 (1980-2420 К); 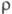 28 мкОм·см; теплопроводность 0,29 Вт/(см·К) при 343 К; температурный коэф. линейного расширения
28 мкОм·см; теплопроводность 0,29 Вт/(см·К) при 343 К; температурный коэф. линейного расширения 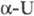 6,8·10-6K-1 (573 К), 9,2·10-6K-1 (773 К); модуль упругости 1758 ГПа;
6,8·10-6K-1 (573 К), 9,2·10-6K-1 (773 К); модуль упругости 1758 ГПа; 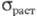 0,344-1,379 ГПа (25 0C), 186,2 МПа (150 0C), 82,7 МПа (600 0C); модуль сдвига 73,1 ГПа; коэф. Пуассона 0,25; коэф. сжимаемости 97,9 ГПа; модуль упругой деформации 0,176 кПа; твердость по Виккерсу 200-300 при комнатной т-ре. При облучении нейтронами урановых блоков изменяются их размеры и форма, ухудшаются мех. св-ва в связи с накоплением продуктов деления урана. Уран слабо парамагнитен, магн. восприимчивость+ 1,6·10-6.
0,344-1,379 ГПа (25 0C), 186,2 МПа (150 0C), 82,7 МПа (600 0C); модуль сдвига 73,1 ГПа; коэф. Пуассона 0,25; коэф. сжимаемости 97,9 ГПа; модуль упругой деформации 0,176 кПа; твердость по Виккерсу 200-300 при комнатной т-ре. При облучении нейтронами урановых блоков изменяются их размеры и форма, ухудшаются мех. св-ва в связи с накоплением продуктов деления урана. Уран слабо парамагнитен, магн. восприимчивость+ 1,6·10-6.
Уран очень реакционноспособен, взаимод. с большинством простых B-B, на воздухе покрывается черной пленкой урана оксидов, порошкообразный уран пирофорен. Реагирует с водой, быстро раств. в соляной и азотной к-тах, медленно - в H2SO4, H3PO4, фтористоводородной к-те, образуя соли уранила UO2+2.
В водных р-рах уран может существовать в степенях окисления от +3 до +6. Стандартные окислит. потенциалы для U(IV)/U(IID -0,52 В, U(V)/U(IV) 0,38 В, U(VI)/U(V) 0,17 В, U(VI)/U(IV) 0,27 В. Для бесконечно разб. водных р-ров DH0обр ионов: -489 (U3+), -591 (U4+), -1032 (UO2+ ), -1019 кДж/моль (UO2+2). Ион U3+ неустойчив, разлагает воду с образованием H2 и U4+, образуется из U4+ под действием сильных восстановителей (напр., порошка Zn) или при элек-трохим. восстановлении; U4+ устойчив в отсутствии воздуха, медленно окисляется воздухом до UO2+2, гидролизуется, образуется в р-рах UO2+2 под действием восстановителей средней силы (напр., Na2S2O6, Pb) или электрохимически; UO+2 неустойчив, быстро диспропорционирует на U4+ и UO22+, наиб. устойчив при рН 2-4, образуется при восстановлении UO2+ амальгамой Zn, H2 или электрохимически; UO22+ наиб, устойчивое состояние. Уран в р-рах гидролизуется при рН > 3. Ионы урана в р-рах имеют характерную окраску: U3+ - красную, U4+ -зеленую, UO22+ - желтую. Склонность к гидролизу и комплек-сообразованию уменьшается в ряду U4+ > UO22+ > U3+ > UO2+. Плохо растворимые в воде соли урана- фосфат, ванадат, сульфид, 8-гидроксихинолинат и др., а также диуранаты щелочных металлов (соли диурановой к-ты H2U2O7) используются для выделения UO22+ из р-ров; иодат, фторид, оксалат, купферо-нат, фениларсонат - для выделения из р-ров U4+.
При нагр. урана в атмосфере H2 при 250-350 0C образуется тригидрид UH3 (табл. 1), к-рый раств. в воде, HNO3 и конц. соляной и серной к-тах, не раств. в р-рах щелочей и аммиака; пирофорен: взрывается в смеси с CCl4: при нагр. выделяет H2; применяется для получения тонкодисперсного урана.
Уран образует простые галогениды UHaIn (п = 3, 4, 5, 6), оксигалогениды UOHaIn (п=1, 2, 3) и уранилгалогсниды UO2HaIn (п = 1, 2), а также комплексные и смешанные галогениды (табл. 2). Наиб, важные из них - урана фториды. Трихлорид UCl3, трибромид UBr3 и тrииодид UI3 синтезируют взаимод. UH3 при 350 0C соотв. с HCl, HBr и HI: UCl3 получакп также р-цией избытка UCl4 с Al или Zn при 400 0C с послед, отгонкой AlCl3 или ZnCl2 и остатка UCl4. Тетрахлорид UCl4 синтезируют взаимод. UO2, с CCl4, COCl2, S2Cl2., SO2Cl2, или РCl5, тетрабrомид UBr4 и тетраиодид UI4 - р-цией U соотв. с Br2 и I2. Соед. UCl4, UBr4 и UI4 весьма гигроскопичны, легко раств. в воде и полярных орг. р-рителях и не раств. в неполярных орг. р-рителях.
Табл. 1.- ХАРАКТЕРИСТИКА НЕКОТОРЫХ СОЕДИНЕНИЙ УРАНА
| Показатель | | UB2 | UB4 | UB12 | U3Si2 | | US | | UP | ||
| Цвет | Серебристо-серый | Серебристо-серый | Серебристо-серый | От коричневого до черного | Светло-серый | Серо-черный | Серо-черный | Серый, черный | |||
| Сингония | Кубич. | Гексагон. | Тетрагон. | Кубич. | Тетрагон. | Тетрагон. | Кубич. | Ромбич. | Кубич. | ||
| Параметры решетки, нм: | | | | | | | | | | ||
| а | 0,4160 | 0,31293 | 0,7075 | 0,44773 | 0,73299 | 0,398 | 0,54903 | 0,44803 | 0,55889 | ||
| с | — | 0,3989 | 0,3979 | — | 0,39004 | 0,1374 | — | 0,7439 | — | ||
| Пространств. группа | Pm3n | P6/mmm | P4/mbm | Fm3m | Р4/тbт | — | Рт3т | Рbab | Fm3m | ||
| T. пл., 0С | 1006 | 2385 | 2495 | 2145 | 1667 | 1700 | 2462 | 1680 | 2850 | ||
| Плотн.а, г/см3 | 11,12 | 12,82 | 9,32 | 5,65 | 11,31 | — | 10,87 | 8,09 | 10,23 | ||
| | - 126,99 | - 164,3 (1770 К) | — | - 252,5 (2060 К) | - 170,5 | - 129,6 | -314,3 | — | -262,1 | ||
а Рентгеновская. 6 Т-ра перехода в др. кубич. форму с плотн. 10,92 г/см3. вИзвестна также гексаген, форма. г Наиб, устойчива; существует также тетрагон, и гексаген. (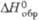 - 525,0 кДж/моль) модификации.
- 525,0 кДж/моль) модификации.
Табл. 2.- ХАРАКТЕРИСТИКА ГАЛОГЕНИДОВ УРАНА
| Показатель | UCl3 | UCl4 | | | UCl6 | UBr3 | UBr4 | UBr5 | UI3 | UI4 | ||
| Цвет | Оливково-зеленый | Зеленый | Красно -коричневый | Коричневый | Темно-зеленый | Красновато-коричневый | Темно-коричневый | — | Черный | Черный | ||
| Сингония | Гексагон. | Тетрагон.a | Моноклинная | Триклинная | Гексагон. | Гексагон. | Моноклинная | Триклинная | Ромбич. | — | ||
| Параметры решетки, нм: | | | | | | | | | | | ||
| a | 0,7442 | 0,8296 | 0,799 | 0,709 | 1,090 | 0,7936 | 1,092 | 0,7449 | 0,4328 | — | ||
| в | — | — | 1,069 | 0,966 | — | — | 0,869 | 1,0127 | 1,3996 | — | ||
| с | 0,4320 | 0.7481 | 0,848 | 0,636 | 0,603 | 0,4438 | 0,705 | 0,6686 | 0,9984 | — | ||
| угол, град | — | — | 91,5 | 88,5 (a), 117,6 (b), 108,5 (g) | — | — | 93,15 | 89,25 (a), 117,56 (b), 108,87 (g) | — | — | ||
| Число формульных единиц в ячейке | 2 | 4 | 4 | — | 3 | 2 | — | — | 4 | — | ||
| Пространств. группа | рб3/т | I4/amd | Р21п | P1 | СЗт | P63/m | _ | P1 | Стст | _ | ||
| T. пл., 0C | 841 | 590б | 327 | — | 177,5 | 730в | 519г | — | 788 | 520д | ||
| Плотн., г/см3 | 5,51 | 4,87 | — | — | 3,59 | 6,55 | — | — | 6,76 | — | ||
| | 102,8 | 121,85 | 150,62 | — | 175,6 | 105,3 | 130,8 | — | — | — | ||
| | - 866,5 | -1017,8 | - 1035,4 | — | -1093,9 | -648,7 | - 800,9 | -811,8 | -441,8 | - 508,7 | ||
| | 158,92 | 197,05 | 242,67 | — | 285,33 | 178 | 242 | — | 238 | 284 | ||
| | 237,4 | 199,0 | 170,1 | — | 74,9 | 307,2 | 224,9 | — | — | 229,1 | ||
аПри 547 0C полиморфный переход, DH перехода 11,7 кДж/моль. 6 DHПЛ 49,91 кДж/моль (590 0C). в DHПЛ 46,0 кДж/моль (730 0C). г DHпл 71,69 кДж/моль (519 0C); т. кип. 765 0C, DHисп 126,2 кДж/моль (765 0C). д DHпл 23,58 (788 0С).
Пентахлорид UCl5 раств. в CCl4, CS2 и тионилхлориде, взаимод. с эфирами, спиртами, кетонами и др. орг. р-рителя-ми: образуется при обработке UCl4 газообразным Cl2 при 500 0C, при взаимод. UO3 (или U3O8) с CCl4 при 250 С. Пентабромид UBr5 получают при взаимод. U с Br2 в присут. катализатора - ацетонитрила. Гексахлорид UCl6 гидролизуется влагой воздуха, бурно реагирует с водой, раств. в CCl4 и CHCl3, не раств. в бензоле; получают диспропорци-онированием UCl5 при 120-150 0C в высоком вакууме.
Боrиды: UB2, UB4, UB12 не раств. в воде. UB2 разлагается конц. HNO3, фтористоводородной к-той, H2O2; получают взаимод. U с В выше 1700 0C. UB4 раств. в HNO3 и фтористоводородной к-те, в кипящей конц. H2SO4; получают электролизом расплава U3O8 и H3BO3 при 1000 0C. UB12 раств. в смеси HNO3 и H2O2, горячей конц. H2SO4, не раств. в горячих конц. соляной и азотной к-тах.
Силициды: U3Si, U3Si2, USi, U3Si5, USi2, USi3. Соед. U3Si2 и USi2 не раств. в воде и неорг. к-тах; получают из U и Si при высоких т-рах: U3Si2 перспективен как компонент твэлов; USi2, обогащенный 235U,- перспективное ядерное топливо.
Сульфиды: U2S3, U3S5, US2, US3, US. Сульфиды US и US2 не раств. в воде, разлагаются неорг. к-тами, US в атмосфере O2 воспламеняется при 375 0C: получают взаимод. U c S или H2S с послед, гомогенизацией при 1800 0C.
Фосфиды: UP, U3P4, UP2. Фосфид UP устойчив к окислению и гидролизу; не раств. в воде, разб. соляной к-те, разлагается кипящей HNO3, царской водкой; получают из простых B-B при 500-600 0C с послед, гомогенизацией при 1000 0C или взаимод. порошка U с PH3 при 500 0C; UP, обогащенный 235U,- перспективное ядерное топливо.
Известны соед. урана с Ge, Sn, Pb, Те и др. См. также Урана карбиды, Урана нитриды, Уранаты, Уранорганичесше соединения.
Получение. Технология урана тесно связана с урановым топливным циклом (см. Ядерный топливный цикл)и состоит из четырех составных частей, отличающихся изотопным составом перерабатываемых B-B и целями переработки. Производят: соед. урана с прир. соотношением изотопов (цель концен-трирование и очистка, подготовка к разделению изотопов или произ-ву Pu); соед., обогащенные изотопом 235U (цель -ироиз-во твэлов ядерных энергетич. установок в виде диоксида или сплавов урана, а также ядерного оружия): соед., обедненные изотопом 235U (цель - безопасное хранение, применение вне энергетики): соед., полученные из облученного ядерного горючего (т. наз. радиохим. произ-во, цель - отделение от Pu и Np, очистка от продуктов деления, подготовка к разделению изотопов и повторному изготовлению твэлов). Кроме того, создаются основы технологии урана применительно к уран-ториевому ядерному топливному циклу (высокотемпературные газовые ядерные реакторы с топливом из 232Th и 233U в виде смешанных диоксидов или карбидов) и к уран-плутониевому циклу (реакторы на быстрых нейтронах с топливом из 239Pu и 238U в виде смешанных диоксидов).
Переработка природных соед. урана включает обогащение руд (получение рудных концентратов), ураново-рудный передел (получение хим. концентратов), аффинаж (получение чистых соед. урана, в частности UF4), сублиматное (гексафторидное) и металлургич. произ-ва. Для обогащения руд используют радиометрич., гравитационные, реже флотац. методы, магн. сепарацию (см. Обогащение полезных ископаемых}. Рудные концентраты обычно подвергают выщелачиванию с добавкой окислителей (MnO2, NaClO3, H2SO4 и др.), концентрируют уран с помощью ионообменной сорбции, осаждают диура-наты водным р-ром NaOH или NH3 и прокаливают до U3O8 (хим. концентрат). Рудные концентраты с высоким содержанием карбонат-ионов выщелачивают р-рами Na2CO3. Этот процесс, а также сернокислотное выщелачивание сульфидсо-держащих руд часто проводят под давлением в автоклавах, используя в качестве окислителя O2. Все большее значение приобретает экологически и экономически более выгодное подземное и кучное выщелачивание. В заметных масштабах извлекают уран при переработке фосфатных руд, в частности экстракцией из техн. H3PO4, а также сорбцией из морской и др. прир. вод.
Для аффинажа урана применяют методы жидкостной экстракции (обычно трибутилфосфатом из азотнокислых сред), сочетая их с сорбцией на ионообменной смоле и осаждением в виде уранатов. Очищенные р-ры солей U(Vl) восстанавливают до U(IV), из них осаждают UF4, к-рый сушат и прокаливают. По др. способу получают UO3, к-рый восстанавливают H2 и далее фторируют образовавшийся UO2 газообразным HF. На сублиматных заводах UF4 фторируют до UF6, на металлургических - восстанавливают Ca или Mg до металла.
Разделение изотопов урана проводят методом диффузии UF6 через пористые мембраны или с помощью центрифуг. Разрабатывают высокоэффективные лазерные методы. Обогащенный изотопом 235U (до содержания не менее 2,5-3,0%) поток UF6 гидролизуют водными р-рами, осаждают и прокаливают осадок, либо подвергают восстановит, пирогидролизу влажным H2 до UO2. Обедненный изотопом 235U (до содержания 0,2-0,4%) UF6 восстанавливают до UF4 и далее до металла, либо подвергают пирогидролизу до U3O8.
Твэлы после удаления оболочки растворяют в HNO3, а р-р очищают методом многоступенчатой экстракции с использованием трибутилфосфата. Очищенный р-р UO2(NO3)2 упаривают, подвергают денитрации и (при необходимости корректировки изотопного состава) превращают полученные оксиды в UF6. Используют также осаждение и прокаливание оксалата уранила UO2C2O4·3H2O или пероксида UO4·2H2O.
Определение. Качественно уран обнаруживают: по яркой желто-зеленой флуоресценции 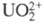 в присут. NaF под действием УФ излучения; по образованию желтой окраски при добавлении H2O2 к карбонатному р-ру или KCNS к кислым р-рам; по красно-бурой окраске р-ра в присут. ферроцианида К или 8-гидрооксихинолина и др.
в присут. NaF под действием УФ излучения; по образованию желтой окраски при добавлении H2O2 к карбонатному р-ру или KCNS к кислым р-рам; по красно-бурой окраске р-ра в присут. ферроцианида К или 8-гидрооксихинолина и др.
Количественно уран определяют: гравиметрически в виде U3O8, (UO2)2P2O7 и др.: титриметрически - в виде U4+ с использованием для титрования KMnO4, K2Cr2O7 и др.: фотометрически - по собств. окраске ионов урана. Субмикрограм-мовые кол-ва урана (10-6-10-10 г) определяют люминесцентным методом. Применяют также электрохим. (полярография, по-тенциометрия, кулонометрия), радиометрич. (уд. a-активность 235U и 238U составляет соотв. 0,08 и 0,012 Бк/мкг), нейтронно-активационный (с использованием нуклидов 239U, 239Np или продуктов деления урана) и атомно-эмиссионный методы анализа.
Применение. Уран используют гл. обр. в виде диоксида или сплавов в качестве ядерного топлива в ядерных реакторах на атомных электростанциях и в двигателях крупных транспортных ср-в (корабли, атомные лодки). При делении ядер 1 кг 235U выделяется ок. 2·107кВт·ч энергии. 235U- источник энергии в ядерном оружии. Критич. масса 235U 50 кг (плотн. 19,5 г/см3, критич. радиус 9 см). 238U применяют для получения 239Pu. 233U - вторичное ядерное топливо. Обедненный изотопом 235U уран используют в бронебойных снарядах и пулях и др. См. также Урана сплавы.
Мировая добыча урана в нач. 80-х гг. 20 в. составляла ок. 50 тыс. т в год (без СССР).
Впервые уран в виде UO2 открыл M. Клапрот в 1789, метал-лич. уран получил Э. Пелиго в 1841.
Уран- общеклеточный яд, поражает все органы и ткани; его действие обусловлено хим. токсичностью и радиоактивностью. ПДК для растворимых соед. урана 0,015 мг/м3, для нерастворимых - 0.075 мг/м. Осн. мероприятия по борьбе с загрязнением воздушной среды пылью при добыче и переработке урана: макс, механизация процессов, герметизация оборудования, использование мокрых способов переработки сырья. MH. операции на радиохим. произ-вах проводят дистанционно, с применением биол. защиты.
Лит.: Громов Б. В., Введение в химическую технологию урана, M., 1978; Химия урана, под ред. Б. H. Ласкорина, M., 1981; Химия урана, под ред. Б. H. Ласкорина, Б. Ф. Мясоедова, M., 1989; Chemistry of the acunide elements, 2 ed., v. 1, N. Y., 1986, p. 169-442. Б. Ф. Мясоедов, Э. Г. Раков.

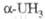
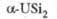

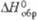 , кДж/моль
, кДж/моль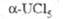

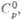 Дж/(моль·К)
Дж/(моль·К)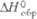 , кДж/моль
, кДж/моль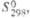 Дж/(моль·К)
Дж/(моль·К)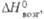 кДж/моль
кДж/моль