Уран (хим. элемент)
Уран (лат. Uranium), U, радиоактивный химический элемент III группы периодической системы Менделеева, относится к семейству актиноидов, атомный номер 92, атомная масса 238,029; металл. Природный уран состоит из смеси трёх изотопов: 238U – 99,2739% с периодом полураспада T1/2 = 4,51·109 лет, 235U – 0,7024% (T1/2 = 7,13·108 лет) и 234U – 0,0057% (T1/2 = 2,48·105 лет). Из 11 искусственных радиоактивных изотопов с массовыми числами от 227 до 240 долгоживущий – 233U (T1/2 = 1,62·105лет); он получается при нейтронном облучении тория. 238U и 235U являются родоначальниками двух радиоактивных рядов.
Историческая справка. Уран открыт в 1789 нем. химиком М. Г. Клапротом и назван им в честь планеты Уран, открытой В. Гершелем в 1781. В металлическом состоянии уран получен в 1841 франц. химиком Э. Пелиго при восстановлении UCl4 металлическим калием. Первоначально урану приписывали атомную массу 120, и только в 1871 Д. И. Менделеев пришёл к выводу, что эту величину надо удвоить.
Длительное время уран представлял интерес только для узкого круга химиков и находил ограниченное применение для производства красок и стекла. С открытием явления радиоактивности урана в 1896 и радия в 1898 началась промышленная переработка урановых руд с целью извлечения и использования радия в научных исследованиях и медицине. С 1942, после открытия в 1939 явления деления ядер (см. Ядра атомного деление), уран стал основным ядерным топливом.
Распространение в природе. Уран – характерный элемент для гранитного слоя и осадочной оболочки земной коры. Среднее содержание урана в земной коре (кларк) 2,5·10-4% по массе, в кислых изверженных породах 3,5·10-4%, в глинах и сланцах 3,2·10-4%, в основных породах 5·10-5%, в ультраосновных породах мантии 3·10-7%. Уран энергично мигрирует в холодных и горячих, нейтральных и щелочных водах в форме простых и комплексных ионов, особенно в форме карбонатных комплексов. Важную роль в геохимии урана играют окислительно-восстановительные реакции, поскольку соединения урана, как правило, хорошо растворимы в водах с окислительной средой и плохо растворимы в водах с восстановительной средой (например, сероводородных).
Известно около 100 минералов урана; промышленное значение имеют 12 из них (см. Урановые руды). В ходе геологической истории содержание урана в земной коре уменьшилось за счёт радиоактивного распада; с этим процессом связано накопление в земной коре атомов РЬ, Не. Радиоактивный распад урана играет важную роль в энергетике земной коры, являясь существенным источником глубинного тепла.
Физические свойства. Уран по цвету похож на сталь, легко поддаётся обработке. Имеет три аллотропические модификации – a, b и g с температурами фазовых превращений: a®b 668,8±0,4°C, b® g 772,2 ± 0,4 °С; a-форма имеет ромбическую решётку a = 2.8538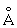 , b = 5,8662
, b = 5,8662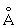 , с = 4,9557
, с = 4,9557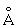 ), b-форма – тетрагональую решётку (при 720 °С а = 10,759
), b-форма – тетрагональую решётку (при 720 °С а = 10,759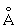 , b = 5,656
, b = 5,656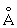 ), g-форма – объёмноцентрированную кубическую решётку (при 850°C а = 3,538
), g-форма – объёмноцентрированную кубическую решётку (при 850°C а = 3,538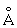 ). Плотность урана в a-форме (25°C) 19,05 ± 0,2 г/см3, tпл 1132 ± 1°С; tkип 3818 °С; теплопроводность (100–200°C), 28,05 вт/(м·К) [0,067 кал/(см·сек·°С)], (200–400 °C) 29,72 вт/(м·К) [0,071 кал/(см·сек·°С)]; удельная теплоёмкость (25°C) 27,67 кдж/(кг·К) [6,612 кал/(г·°С)]; удельное электросопротивление при комнатной температуре около 3·10-7 ом·см, при 600°C 5,5·10-7 ом·см; обладает сверхпроводимостью при 0,68 ± 0,02К; слабый парамагнетик, удельная магнитная восприимчивость при комнатной температуре 1,72·10-6.
). Плотность урана в a-форме (25°C) 19,05 ± 0,2 г/см3, tпл 1132 ± 1°С; tkип 3818 °С; теплопроводность (100–200°C), 28,05 вт/(м·К) [0,067 кал/(см·сек·°С)], (200–400 °C) 29,72 вт/(м·К) [0,071 кал/(см·сек·°С)]; удельная теплоёмкость (25°C) 27,67 кдж/(кг·К) [6,612 кал/(г·°С)]; удельное электросопротивление при комнатной температуре около 3·10-7 ом·см, при 600°C 5,5·10-7 ом·см; обладает сверхпроводимостью при 0,68 ± 0,02К; слабый парамагнетик, удельная магнитная восприимчивость при комнатной температуре 1,72·10-6.
Механические свойства урана зависят от его чистоты, от режимов механической и термической обработки. Среднее значение модуля упругости для литого урана 20,5·10-2 Мн/м2 [20,9·10-3 кгс/мм2] предел прочности при растяжении при комнатной температуре 372–470 Мн/м2 [38–48 кгс/мм2], прочность повышается после закалки из b- и g-фаз; средняя твёрдость по Бринеллю 19,6–21,6·102 Мн/м2 [200–220 кгс/мм2].
Облучение потоком нейтронов (которое имеет место в ядерном реакторе) изменяет физико-механические свойства урана: развивается ползучесть и повышается хрупкость, наблюдается деформация изделий, что заставляет использовать уран в ядерных реакторах в виде различных урановых сплавов.
Уран – радиоактивный элемент. Ядра 235U и 233U делятся спонтанно, а также при захвате как медленных (тепловых), так и быстрых нейтронов с эффективным сечением деления 508·10-24 см2 (508 барн) и 533·10-24 см2 (533 барн) соответственно. Ядра 238U делятся при захвате только быстрых нейтронов с энергией не менее 1 Мэв; при захвате медленных нейтронов 238U превращается в 239Pu, ядерные свойства которого близки к 235U. Критич. масса урана (93,5% 235U) в водных растворах составляет менее 1 кг, для открытого шара – около 50 кг, для шара с отражателем – 15 – 23 кг; критическая масса 233U – примерно 1/3 критической массы 235U.
Химические свойства. Конфигурация внешней электронной оболочки атома урана 7s26d15f3. Уран относится к реакционноспособным металлам, в соединениях проявляет степени окисления + 3, + 4, + 5, + 6, иногда + 2; наиболее устойчивы соединения U (IV) и U (VI). На воздухе медленно окисляется с образованием на поверхности плёнки двуокиси, которая не предохраняет металл от дальнейшего окисления. В порошкообразном состоянии уран пирофорен и горит ярким пламенем. С кислородом образует двуокись UO2, трёхокись UO3 и большое число промежуточных окислов, важнейший из которых U3O8. Эти промежуточные окислы по свойствам близки к UO2 и UO3. При высоких температурах UO2 имеет широкую область гомогенности от UO1,60 до UO2,27. С фтором при 500–600°C образует тетрафторидирд (зелёные игольчатые кристаллы, малорастворимые в воде и кислотах) и гексафторид UF6 (белое кристаллическое вещество, возгоняющееся без плавления при 56,4°C); с серой – ряд соединений, из которых наибольшее значение имеет US (ядерное горючее). При взаимодействии урана с водородом при 220 °С получается гидрид UH3; с азотом при температуре от 450 до 700 °С и атмосферном давлении – нитрид U4N7, при более высоком давлении азота и той же температуре можно получить UN, U2N3 и UN2; с углеродом при 750–800°C – монокарбид UC, дикарбид UC2, а также U2C3; с металлами образует сплавы различных типов (см. Урановые сплавы). Уран медленно реагирует с кипящей водой с образованием UO2 и H2, с водяным паром – в интервале температур 150–250 °С; растворяется в соляной и азотной кислотах, слабо – в концентрированной плавиковой кислоте. Для U (VI) характерно образование иона уранила UO22 +; соли уранила окрашены в жёлтый цвет и хорошо растворимы в воде и минеральных кислотах; соли U (IV) окрашены в зелёный цвет и менее растворимы; ион уранила чрезвычайно способен к комплексообразованию в водных растворах как с неорганическими, так и с органическими веществами; наиболее важны для технологии карбонатные, сульфатные, фторидные, фосфатные и др. комплексы. Известно большое число уранатов (солей не выделенной в чистом виде урановой кислоты), состав которых меняется в зависимости от условий получения; все уранаты имеют низкую растворимость в воде.
Уран и его соединения радиационно и химически токсичны. Предельно допустимая доза (ПДД) при профессиональном облучении 5 бэр в год.
Получение. Уран получают из урановых руд, содержащих 0,05–0,5% U. Руды практически не обогащаются, за исключением ограниченного способа радиометрической сортировки, основанной на излучении радия, всегда сопутствующего урану. В основном руды выщелачивают растворами серной, иногда азотной кислот или растворами соды с переводом урана в кислый раствор в виде UO2SO4 или комплексных анионов [UO2(SO4)3]4-, а в содовый раствор – в виде [UO2(CO3)3]4-. Для извлечения и концентрирования урана из растворов и пульп, а также для очистки от примесей применяют сорбцию на ионообменных смолах и экстракцию органическими растворителями (трибутилфосфат, алкилфосфорные кислоты, амины). Далее из растворов добавлением щёлочи осаждают уранаты аммония или натрия или гидроокись U (OH)4. Для получения соединений высокой степени чистоты технические продукты растворяют в азотной кислоте и подвергают аффинажным операциям очистки, конечными продуктами которых являются UO3 или U3O8; эти окислы при 650–800°C восстанавливаются водородом или диссоциированным аммиаком до UO2 с последующим переводом его в UF4 обработкой газообразным фтористым водородом при 500–600°C. UF4 может быть получен также при осаждении кристаллогидрата UF4·nH2O плавиковой кислотой из растворов с последующим обезвоживанием продукта при 450°C в токе водорода. В промышленности основным способом получения урана из UF4 является его кальциетермическое или магниетермическое восстановление с выходом урана в виде слитков массой до 1,5 т. Слитки рафинируются в вакуумных печах.
Очень важным процессом в технологии урана является обогащение его изотопом 235U выше естественного содержания в рудах или выделение этого изотопа в чистом виде (см. Изотопов разделение), поскольку именно 235U – основное ядерное горючее; осуществляется это методами газовой термодиффузии, центробежными и др. методами, основанными на различии масс 235U и 238U; в процессах разделения урана используется в виде летучего гексафторида UF6. При получении урана высокой степени обогащения или изотопов учитываются их критические массы; наиболее удобный способ в этом случае – восстановление окислов урана кальцием; образующийся при этом шлак CaO легко отделяется от урана растворением в кислотах.
Для получения порошкообразного урана, двуокиси, карбидов, нитридов и др. тугоплавких соединений применяются методы порошковой металлургии.
Применение. Металлический уран или его соединения используются в основном в качестве ядерного горючего в ядерных реакторах. Природная или малообогащённая смесь изотопов урана применяется в стационарных реакторах атомных электростанций, продукт высокой степени обогащения – в ядерных силовых установках или в реакторах, работающих на быстрых нейтронах. 235U является источником ядерной энергии в ядерном оружии. 238U служит источником вторичного ядерного горючего – плутония.
В. М. Кулифеев.
Уран в организме. В микроколичествах (10-5–10-5%) обнаруживается в тканях растений, животных и человека. В золе растений (при содержании урана в почве около·10-4) его концентрация составляет 1,5·10-5%. В наибольшей степени уран накапливается некоторыми грибами и водорослями (последние активно участвуют в биогенной миграции урана по цепи вода – водные растения – рыба – человек). В организм животных и человека уран поступает с пищей и водой в желудочно-кишечный тракт, с воздухом в дыхательные пути, а также через кожные покровы и слизистые оболочки. Соединения урана всасываются в желудочно-кишечном тракте – около 1% от поступающего количества растворимых соединений и не более 0,1% труднорастворимых; в лёгких всасываются соответственно 50% и 20%. Распределяется уран в организме неравномерно. Основные депо (места отложения и накопления) – селезёнка, почки, скелет, печень и, при вдыхании труднорастворимых соединений, – лёгкие и бронхо-лёгочные лимфатические узлы. В крови уран (в виде карбонатов и комплексов с белками) длительно не циркулирует. Содержание урана в органах и тканях животных и человека не превышает 10-7 г/г. Так, кровь крупного рогатого скота содержит 1·10-8 г/мл, печень 8·10-8 г/г, мышцы 4·10-8 г/г, селезёнка 9·10-8 г/г. Содержание урана в органах человека составляет: в печени 6·10-9 г/г, в лёгких 6·10-9–9·10-9г/г, в селезёнке 4,7·10-9 г/г, в крови 4·10-9 г/мл, в почках 5,3·10-9 (корковый слой) и 1,3·10-9 г/г (мозговой слой), в костях 1·10-9 г/г, в костном мозге 1·10-9 г/г, в волосах 1,3·10-7г/г. Уран, содержащийся в костной ткани, обусловливает её постоянное облучение (период полувыведения урана из скелета около 300 сут). Наименьшие концентрации урана – в головном мозге и сердце (10-10 г/г). Суточное поступление урана с пищей и жидкостями – 1,9·10-6 г, с воздухом – 7·10-9 г. Суточное выведение урана из организма человека составляет: с мочой 0,5·10-7–5·10-7, с калом – 1,4·10-6–1,8·10-6 г, с волосами – 2·10-8г.
По данным Международной комиссии по радиационной защите, среднее содержание урана в организме человека 9·10-8 г. Эта величина для различных районов может варьировать. Полагают, что уран необходим для нормальной жизнедеятельности животных и растений, однако его физиологические функции не выяснены.
Г. П. Галибин.
Токсическое действие урана обусловлено его химическими свойствами и зависит от растворимости: более токсичны уранил и др. растворимые соединения уран Отравления ураном и его соединениями возможны на предприятиях по добыче и переработке уранового сырья и др. промышленных объектах, где он используется в технологическом процессе. При попадании в организм уран действует на все органы и ткани, являясь общеклеточным ядом. Признаки отравления обусловлены преим. поражением почек (появление белка и сахара в моче, последующая олигурия), поражаются также печень и желудочно-кишечный тракт. Различают острые и хронические отравления; последние характеризуются постепенным развитием и меньшей выраженностью симптомов. При хронической интоксикации возможны нарушения кроветворения, нервной системы и др. Полагают, что молекулярный механизм действия урана связан с его способностью подавлять активность ферментов.
Профилактика отравлений: непрерывность технологических процессов, использование герметичной аппаратуры, предупреждение загрязнения воздушной среды, очистка сточных вод перед спуском их в водоёмы, мед. контроль за состоянием здоровья рабочих, за соблюдением гигиенических нормативов допустимого содержания урана и его соединений в окружающей среде.
В. Ф. Кириллов.
Лит.: Учение о радиоактивности. История и современность, под ред. Б. М. Кедрова, М., 1973; Петросьянц А. М., От научного поиска к атомной промышленности, М., 1970; Емельянов В. С., Евстюхин А. И., Металлургия ядерного горючего, М., 1964; Сокурский Ю. Н., Стерлин Я. М., Федорченко В. А., Уран и его сплавы, М., 1971; Евсеева Л. С., Перельман А. И., Иванов К. Е., Геохимия урана в зоне гнпергениза, 2 изд., М., 1974; Фармакология и токсикология урановых соединений, [пер. с англ.], т. 2, М., 1951; Гуськова В. Н., Уран. Радиационно-гигиеническая характеристика, М., 1972; Андреева О. С., Гигиена труда при работе с ураном и его соединениями, М., 1960; Новиков Ю. В,, Гигиенические вопросы изучения содержания урана во внешней среде и его влияния на организм, М., 1974.
