Фтористый водород
ФТОРИСТЫЙ ВОДОРОД HF, бесцв. газ или подвижная жидкость, дымящая на воздухе; т. пл. -83,36 0C, т. кип. 19,520C; tкрит 230 0C, dкрит 0,29 г/см3, ркрит 6,49 МПа; 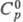 29,14 Дж/(моль·К);
29,14 Дж/(моль·К); 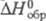 -273,3 кДж/моль;
-273,3 кДж/моль;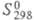 173,675 Дж/(моль·К);
173,675 Дж/(моль·К); 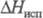 = 7,489 - 43,9(7- 292,69) кДж/моль (250
= 7,489 - 43,9(7- 292,69) кДж/моль (250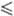 T
T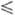 390 К); ур-ние температурной зависимости давления пара над фтористым водородом lgp (Па) = 0,21317 - 918,24/Т + + 3,21542 lgT, где 193
390 К); ур-ние температурной зависимости давления пара над фтористым водородом lgp (Па) = 0,21317 - 918,24/Т + + 3,21542 lgT, где 193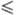 T
T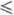 378 К. Плотн. жидкого HF близка к плотн. воды: d = 1,0020 - 2,2625·10-3t + 3,125·10-6t г/см3, где -74
378 К. Плотн. жидкого HF близка к плотн. воды: d = 1,0020 - 2,2625·10-3t + 3,125·10-6t г/см3, где -74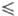 t
t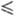 42 0C;
42 0C; 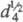 0,98. Чистый жидкий HF почти не ионизирован, r 10-6 Ом·см (0 0C); следовые кол-ва примесей, в т. ч. воды, резко понижают r.
0,98. Чистый жидкий HF почти не ионизирован, r 10-6 Ом·см (0 0C); следовые кол-ва примесей, в т. ч. воды, резко понижают r.
Характерное св-во HF - склонность к ассоциации. Средняя степень ассоциации в жидкости n = 6. В газовой фазе могут присутствовать линейные и циклич. олигомеры с n — 4,6-12. Наиб. устойчив циклич. (HF)6.
Фтористый водород реагирует со мн. простыми в-вами с образованием фторидов, с оксидами - оксифторидов или фторидов, замещает галоген в галогенидах металлов, с фторидами щелочных и др. одновалентных металлов образует гидрофториды металлов, с фторидами и оксифторидами мн. элементов в присут. воды - фторсодержащие к-ты, напр. H2SiF6, HBF4.
Фтористый водород неограниченно раств. в воде с образованием фтористоводородной кислоты. Сам HF - хороший р-ритель для мн. в-в. Наиб. р-римость характерна для SbF5 (смешивается неограниченно), TlF (580 г в 100 г HF при 12 oС) и CsF (199 г в 100 г HF при 10 0C). Р-римость фторидов щелочных металлов (кроме LiF) в HF в 2-4 раза ниже, чeм в воде, BaF2, PbF2 и CoF2 - в сотни, BeF2 - в тысячи, a AgF - в сотни тысяч раз больше, чем в воде, что связано с сильной сольватацией фторид-иона в HF.
Фтористый водород- сильная к-та, ф-ция кислотности Гаммета -15,05, однако даже небольшой избыток фторид-ионов резко ее снижает.
Осн. способ получения HF - р-ция флюорита CaF2 с H2SO4, к-рую проводят в трубчатых вращающихся и шнековых печах при 120-180 0C. Реакционные газы очищают от пыли, конденсируют из них HF и подвергают его двухступенчатой ректификации. Менее распространены сернокислотное разложение NH4HF2 и термич. разложение NH4HF2. В лаборатории HF удобно получать термич. разложением гидрофторидов.
Фтористый водород- катализатор гидрирования, дегидрирования, алкили-рования в орг. химии, реагент в произ-ве хладонов и фторопластов, UF4, AlF3 и др., исходное в-во для получения F2, фторсульфоновой к-ты. Мировое произ-во (вместе с фтористоводородной к-той) св. 1 млн. т в год (1980-е гг.).
Фтористый водород раздражает дыхательные пути, является сильнейшим водоотнимающим в-вом и при попадании на кожу вызывает образование долго не заживающих язв, а при длительной экспозиции - обугливание. ПДК в атм. воздухе 0,005 мг/м3, в воде 0,05 мг/л.
Жидкий фтористый водород хранят в стальных герметичных танках и цистернах, а также в баллонах аммиачного типа, имеющих защитную окраску с красной полосой.
Лит.: Запольская М.А., Зенкевич Н.Г., Комарова Е.Г., Физико-химические свойства фтористого водорода, M., 1977; Раков Э.Г., Химия и технология неорганических фторидов, M., 1990. Э.Г. Раков.
