Аммиак
АММИАК (от греч. hals ammoniakos, букв. - амонова соль; так назывался нашатырь, к-рый получали близ храма бога Амона в Египте) NH3, бесцв. газ с резким запахом. Молекула имеет форму правильной пирамиды (см. рис. 1). Связи N— Н полярны;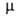 4,85*10-30 Кл*м (0-150°С); энергия связи N—Н 389,4 кДж/моль. Поляризуемость молекулы 22,6*10-25 см3. У атома N имеется неподеленная пара электронов, к-рая обусловливает способность аммиака к образованию донорно-акцепторной и водородной связей. Существование водородных связей и значительная полярность молекул аммиака - причины сильного взаимодействия между ними, вследствие чего физические свойства аммиака во многом аномальны по сравнению со св-вами однотипных соединений (РН3, SbH3, AsH3). Для NH3 т. пл. -77,7°С, т. кип. -33,35°С; dt4 0,790 (-40°С), 0,681 (-33,35°С), 0,639 (0°С), 0580 (40 °С); tкрит 133°С, pкрит 11,425 кПа, dкрит 0,235 г/см3;
4,85*10-30 Кл*м (0-150°С); энергия связи N—Н 389,4 кДж/моль. Поляризуемость молекулы 22,6*10-25 см3. У атома N имеется неподеленная пара электронов, к-рая обусловливает способность аммиака к образованию донорно-акцепторной и водородной связей. Существование водородных связей и значительная полярность молекул аммиака - причины сильного взаимодействия между ними, вследствие чего физические свойства аммиака во многом аномальны по сравнению со св-вами однотипных соединений (РН3, SbH3, AsH3). Для NH3 т. пл. -77,7°С, т. кип. -33,35°С; dt4 0,790 (-40°С), 0,681 (-33,35°С), 0,639 (0°С), 0580 (40 °С); tкрит 133°С, pкрит 11,425 кПа, dкрит 0,235 г/см3;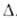 Н°исп 23,27 кДж/моль,
Н°исп 23,27 кДж/моль,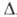 Н°пл, 5,86 кДж/моль; для газа Ср° 35,63 Дж/(моль*К),
Н°пл, 5,86 кДж/моль; для газа Ср° 35,63 Дж/(моль*К),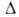 Ноo6p -45,94 кДж/моль, S°298 192,66 Дж/(моль*К).
Ноo6p -45,94 кДж/моль, S°298 192,66 Дж/(моль*К).
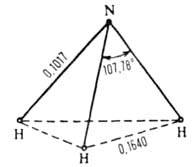
Рис. 1. Структура молекулы NH3 (длина связи - в нм).
Твердый аммиак - бесцв. кристаллы с кубич. решеткой (а = = 0,515 нм, 2 = 4, пространств, группа Р213). В жидком аммиаке молекулы ассоциированы вплоть до критич. т-ры, электролитич. диссоциация совершенно ничтожна, произведение концентраций [NH;][NH2] составляет 10-22 (-33,4°С);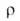 8*106 Ом*см;
8*106 Ом*см;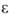 25,4 ( - 77 оС). Жидкий аммиак растворяет щелочные и щел.-зем. металлы, Al, Eu, Yb, P, S, I, мн. интерметаллиды и др. Р-ры металлов в жидком аммиаке имеют металлич. проводимость, поскольку содержат ионы металла и сольватированные электроны; они являются сильнейшими восстановителями. Растворенные в аммиаке соед. с полярной ковалентной или ионной связью диссоциируют на ионы. В жидком аммиаке многие в-ва способны отщеплять протон, кислотные св-ва проявляют в нем даже углеводы, амиды к-т, нек-рые углеводороды.
25,4 ( - 77 оС). Жидкий аммиак растворяет щелочные и щел.-зем. металлы, Al, Eu, Yb, P, S, I, мн. интерметаллиды и др. Р-ры металлов в жидком аммиаке имеют металлич. проводимость, поскольку содержат ионы металла и сольватированные электроны; они являются сильнейшими восстановителями. Растворенные в аммиаке соед. с полярной ковалентной или ионной связью диссоциируют на ионы. В жидком аммиаке многие в-ва способны отщеплять протон, кислотные св-ва проявляют в нем даже углеводы, амиды к-т, нек-рые углеводороды.
Р-римость аммиака в воде (% по массе): 42,8 (0°С, 33,1 (20°С), 23,4 (40°С), 14,1 (60°С). Плотность водных р-ров (г/см3): 0,970 (8% по массе NH3), 0,947 (16%), 0,889 (32%), 0,832 (50%), 0,733 (75%). Для бесконечно разб. водного р-ра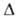 Норастворения 133,26 кДж/моль. Аммиак хорошо раств. (но хуже, чем в воде) в спирте, ацетоне, хлороформе, бензоле и др. орг. р-рителях. Образует гидраты с двумя (т. пл. ок. - 90 °С), одной ( - 79 °С) и 0,5 ( - 78,2 °С) молекулами воды.
Норастворения 133,26 кДж/моль. Аммиак хорошо раств. (но хуже, чем в воде) в спирте, ацетоне, хлороформе, бензоле и др. орг. р-рителях. Образует гидраты с двумя (т. пл. ок. - 90 °С), одной ( - 79 °С) и 0,5 ( - 78,2 °С) молекулами воды.
В системе NH3—Н2О установлено существование эвтек-тик: лед + NН3*Н2О (33,23% по массе NH3, т. пл. -100,3оС), NH3*H2O + NH3*0,5H2O (55,11%, -83,3°С), NH3*H2O + NH3 (80,05%, - 92,5°С). В водном р-ре аммиак частично ионизирован на NH4+ и ОН , что обусловливает щелочную р-цию р-ра (рКа 9,247).
Разложение аммиака на водород и азот становится заметным выше 1200-1300 °С, в присут. катализаторов - выше 400°С. Аммиак весьма реакционноспособен. Для него типичны р-ции присоединения, в частности протона при взаимод. с к-тами. В результате образуются соли аммония, к-рые по многим св-вам подобны солям щелочных металлов.
Аммиак - основание Льюиса, присоединяет не только Н+ , но и др. акцепторы электронов, напр. BF3 с образованием BF3*NH3. Дает аммины при взаимод. с солями. Щелочные и щел.-зем. металлы реагируют с жидким и газообразным аммиаком, давая амиды. При нагр. в атмосфере аммиака многие металлы и неметаллы (Zn, Cd, Fe, Cr, B, Si и др.) образуют нитриды. Жидкий аммиак взаимод. с серой по р-ции: 10S + 4NH3 -> 6H2S + N4S4. Ок. 1000°С аммиак реагирует с углем, образуя HCN и частично разлагаясь на N2 и Н2. Большое практич. значение имеет р-ция аммиака с СО2, ведущая к образованию карбамата аммония NH2COONH4, к-рый при 160-200 °С и давл. до 40 МПа распадается на воду и мочевину. Водород в аммиаке может быть замещен галогенами. Аммиак горит в атмосфере О2, образуя воду и N2. Каталитич. окислением аммиака получают NO промежут. продукт в произ-ве HNO3. Каталитич. окисление аммиака в смеси с СН4 дает HCN. Такие сильные окислители, как Н2О2, К2Сr2О7 и КМnО4, окисляют аммиак в водных р-рах. Газообразный аммиак окисляется Вr2 и С12 до N2.
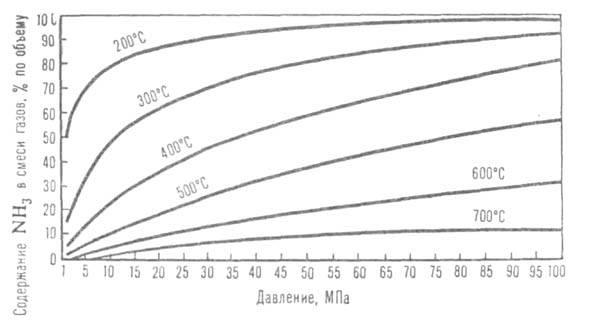
Рис. 2. Зависимость равновесного содержания NH3 в газовой смеси (Н2: N2 = 3) от давления при разных температурах. 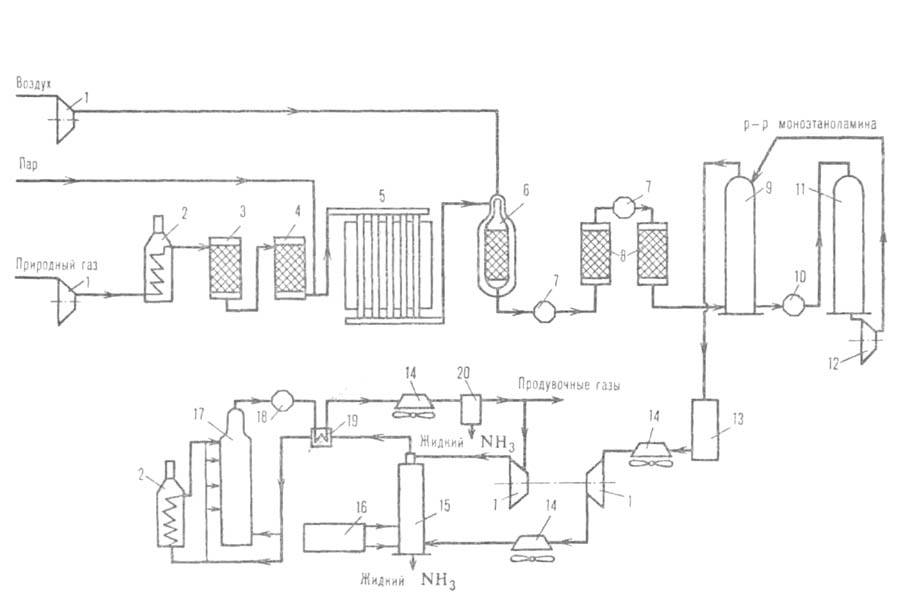
Рис. 3. Агрегат синтеза аммиака мощностью 1360 т/сут: 1-компрессоры; 2-подогреватели; 3-аппарат для тарирования сераорг. соед.; 4-адсорбер H2S; 5-трубчатая печь (первичный риформинг); 6-шахтный конвертор (вторичный риформинг); 7-паровые котлы; 8-конверторы СО; 9-абсорбер СО2; 10-кипятильник; 11 -регенератор р-ра моноэтаноламина; 12-насос; 13-аппарат для гидрирования остаточных СО и СО2; 14-воздушные холодильники; 15-конденсац. колонна; 16-испаритель жидкого NH3 (для охлаждения газа и выделения NH3); 17-колонна синтеза NН3; 18-водоподогреватель; 19-теплообменник; 20-сепаратор.
Осн. пром. способ получения аммиака - по р-ции 1/2N2 + 3/2H2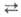 NH3. Сдвигу равновесия вправо способствуют повышение давления и понижение т-ры (см. рис. 2). Тепловой эффект р-ции при 29,4 МПа составляет 52,38 кДж/моль при 500°С и 51,29 кДж/моль при 400°С (с учетом теплоты смешения газов). Процесс проводят в присут. кат.- Fe, активированного К2О, А12О3, СаО и др. Каталитич. яды - сернистые и кислородсодержащие соединения. Для известных катализаторов скорость р-ции описывается ур-нием Темкина - Пыжева:
NH3. Сдвигу равновесия вправо способствуют повышение давления и понижение т-ры (см. рис. 2). Тепловой эффект р-ции при 29,4 МПа составляет 52,38 кДж/моль при 500°С и 51,29 кДж/моль при 400°С (с учетом теплоты смешения газов). Процесс проводят в присут. кат.- Fe, активированного К2О, А12О3, СаО и др. Каталитич. яды - сернистые и кислородсодержащие соединения. Для известных катализаторов скорость р-ции описывается ур-нием Темкина - Пыжева:
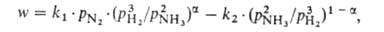
где w-наблюдаемая скорость процесса, равная разности скоростей образования и разложения A., kl и k2-константы скорости образования и разложения аммиака, рH2 , pN2 и pNH3 -парциальное давление соответствующего газа,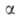 =0,5 для большинства пром. катализаторов. При давл. ~ 30 МПа и т-ре ~ 500 °С, используемых на практике, равновесная концентрация аммиака в газовой смеси составляет ~ 30%. Однако равновесие на выходе из колонны синтеза, как правило, не достигается, поскольку с целью увеличения производительности единицы объема катализатора процесс проводят при высоких объемных скоростях ( ~ 15000 ч -1). Поэтому при однократном прохождении через массу катализатора возможно превращ. в аммиак лишь 15-25% исходной газовой смеси. Для полного превращ. необходима многократная циркуляция, к-рую осуществляют с помощью компрессора. В цикл непрерывно вводят свежую газовую смесь взамен пошедшей на образование аммиака. Осн. сырье (~ 90%) для получения Н2 в произ-ве аммиака - прир. газ, перерабатываемый в осн. методом двуступенчатой паровой конверсии (см. Водород); незначит. долю (менее 10%) составляет коксовый газ и электролитич. водород. Мощность установок по произ-ву аммиака из прир. газа 200 и 420 тыс. т/год. Произ-во аммиака в агрегатах мощностью 1360 т/сут осуществляется в одной технол. линии (см. рис. 3) и включает след. стадии: 1) очистку прир. газа от сернистых соед. каталитич. гидрированием их до H2S с послед. его поглощением ZnO; 2) паровую конверсию прир. газа под давл. 3,8 МПа при 860°С на катализаторе Ni-Al в трубчатой печи (первичный риформинг); 3) паровоздушную конверсию остаточного метана в шахтном конверторе (вторичный риформинг) при 990-1000°С и 3,3 МПа, на катализаторе Ni-Al; на этом этапе водород обогащается азотом воздуха для получения смеси состава Н2: N2 = 3, поступающей на синтез NH3; 4) конверсию СО до СО2 и Н2 сначала при 450°С и 3,1 МПа на катализаторе Fe-Cr, затем при 200-260°С и 3,0 МПа на катализаторе Zn-Cr-Cu; 5) очистку Н2 от СО2 абсорбцией р-ром моноэтаноламина или горячим р-ром К2СО3 при 2,8 МПа; 6) очистку газа путем гидрирования от остаточных СО и СО2 в присут. Ni-Al при 280°С и 2,6 МПа; 7) компримирование очищенного газа до 30 МПа и синтез аммиака на железном промотированном катализаторе при 420-500 °С. Реактор синтеза аммиака представлен на рис. 4.
=0,5 для большинства пром. катализаторов. При давл. ~ 30 МПа и т-ре ~ 500 °С, используемых на практике, равновесная концентрация аммиака в газовой смеси составляет ~ 30%. Однако равновесие на выходе из колонны синтеза, как правило, не достигается, поскольку с целью увеличения производительности единицы объема катализатора процесс проводят при высоких объемных скоростях ( ~ 15000 ч -1). Поэтому при однократном прохождении через массу катализатора возможно превращ. в аммиак лишь 15-25% исходной газовой смеси. Для полного превращ. необходима многократная циркуляция, к-рую осуществляют с помощью компрессора. В цикл непрерывно вводят свежую газовую смесь взамен пошедшей на образование аммиака. Осн. сырье (~ 90%) для получения Н2 в произ-ве аммиака - прир. газ, перерабатываемый в осн. методом двуступенчатой паровой конверсии (см. Водород); незначит. долю (менее 10%) составляет коксовый газ и электролитич. водород. Мощность установок по произ-ву аммиака из прир. газа 200 и 420 тыс. т/год. Произ-во аммиака в агрегатах мощностью 1360 т/сут осуществляется в одной технол. линии (см. рис. 3) и включает след. стадии: 1) очистку прир. газа от сернистых соед. каталитич. гидрированием их до H2S с послед. его поглощением ZnO; 2) паровую конверсию прир. газа под давл. 3,8 МПа при 860°С на катализаторе Ni-Al в трубчатой печи (первичный риформинг); 3) паровоздушную конверсию остаточного метана в шахтном конверторе (вторичный риформинг) при 990-1000°С и 3,3 МПа, на катализаторе Ni-Al; на этом этапе водород обогащается азотом воздуха для получения смеси состава Н2: N2 = 3, поступающей на синтез NH3; 4) конверсию СО до СО2 и Н2 сначала при 450°С и 3,1 МПа на катализаторе Fe-Cr, затем при 200-260°С и 3,0 МПа на катализаторе Zn-Cr-Cu; 5) очистку Н2 от СО2 абсорбцией р-ром моноэтаноламина или горячим р-ром К2СО3 при 2,8 МПа; 6) очистку газа путем гидрирования от остаточных СО и СО2 в присут. Ni-Al при 280°С и 2,6 МПа; 7) компримирование очищенного газа до 30 МПа и синтез аммиака на железном промотированном катализаторе при 420-500 °С. Реактор синтеза аммиака представлен на рис. 4.
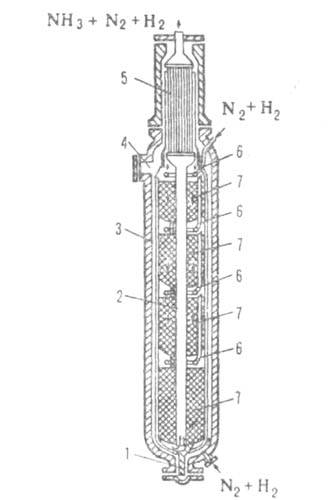
Рис. 4. Колонна синтеза аммиака: 1-люк для выгрузки катализатора; 2-центр, труба; 3-корпус; 4-люк для загрузки катализатора; 5 -теплообменник; 6-трубы для ввода холодного газа; 7 - катализатор.
Аммиак выпускается в жидком виде либо в виде водного р-ра-аммиачной воды, чаще всего с содержанием 25% NH3. Аммиак, поставляемый на нужды пром-сти, содержит не менее 99,96% по массе NH3, до 0,04% Н2О, до 2 мг/л машинного масла, до 1,0 мг/л Fe. В техн. аммиак, транспортируемый по трубопроводу, добавляется до 0,2-0,4% Н2О для ингибирования коррозии стали. Аммиак обнаруживается по характерному запаху. Бумажка, смоченная р-ром Hg2(NO3)2, при действии аммиака чернеет. Малые кол-ва аммиака в водных р-рах открывают с помощью реактива Несслера. Количественно аммиак определяют титриметрически.
Применяют аммиак в произ-ве HNO3, мочевины, NH4NO3, (NH4)2CO3, (NH4)2SO4 и др., аммофоса, уротропина, как жидкое удобрение, в кач-ве хладагента. Мировое произ-во аммиака составило в 1982 ок. 89 млн. т, в т.ч. в СССР 17,76, США 14.06, СРР 3,14, Франции 1,9, Японии 2,01, ФРГ 1,92 млн. т.
Жидкий аммиак хранят при 2,0 МПа или при атм. давлении и — 33°С. Перевозят в стальных баллонах (окрашены в желтый цвет, имеют надпись "Аммиак" черного цвета), железнодорожных и автомобильных цистернах, по воде - в спец. танкерах, транспортируют также по трубопроводам. При содержании в воздухе 0,5% по объему аммиак сильно раздражает слизистые оболочки. При остром отравлении поражаются глаза и дыхат. пути, при хронич. отравлениях наблюдаются расстройство пищеварения, катар верх. дыхат. путей, ослабление слуха. Жидкий аммиак вызывает сильные ожоги кожи. ПДК 20 мг/м3. Смесь аммиака с воздухом взрывоопасна, КПВ 15-28%; для воздушно-аммиачных смесей, содержащих 9-57% по объему аммиака, т. всп. ок. 1000°С. Чистый аммиак был получен Дж. Пристли в 1774.
Литература
Малина И. К., Развитие исследований в области синтеза аммиака, М., 1973; Алексеев А. М. [и др.], "Ж. Всес. хим. о-ва им. Д.И.Менделеева", 1978, т. 23, [№] 1, с 31-38; Синтез аммиака, М., 1982; Жаворонков Н. М., Овчаренко Б. Г., Охотский С. М., в кн.: Развитие химической промышленности в СССР, т. 2, М., 1984, с. 7-37. См. также лит. при ст. Азот. Н.М. Жаворонков, Л. Д. Кузнецов.
