Лёд
Лёд, вода в твёрдом состоянии; известно 10 кристаллических модификаций льда и аморфный лёд. На рис. 1 изображена фазовая диаграмма воды, из которой видно, при каких температурах и давлениях устойчива та или иная модификация. Наиболее изученным является лёд 1 (табл. 1 и 2) — единственная модификация льда, обнаруженная в природе. Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного и т.д.), а также в виде снега, инея и т.д. Природный лёд обычно значительно чище, чем вода, т.к. растворимость веществ (кроме NH4F) во льде крайне плохая. Лёд может содержать механические примеси — твёрдые частицы, капельки концентрированных растворов, пузырьки газа. Наличием кристалликов соли и капелек рассола объясняется солоноватость морского льда. Общие запасы льда на Земле около 30 млн. км3. Имеются данные о наличии льда на планетах Солнечной системы и в кометах. Основные запасы льда на Земле сосредоточены в полярных странах (главным образом в Антарктиде, где толщина слоя льда достигает 4 км).
Табл. 1. — Некоторые свойства льда I
| Свойство | Значение | Примечание |
| Теплоемкость, кал/(г··°C) Теплота таяния, кал/г Теплота парообразования, кал/г | 0,51 (0°C) 79,69 677 | Сильно уменьшается с понижением температуры |
| Коэффициент термического расширения, 1/°C | 9,1·10—5 (0°C) |
|
| Теплопроводность, кал/(см сек··°C) | 4,99·10—3 |
|
| Показатель преломления: для обыкновенного луча для необыкновенного луча |
1,309 (—3°C) 1,3104 (—3°C) |
|
| Удельная электрическая проводимость, ом—1·см—1 |
10—9 (0°C) | Кажущаяся энергия активации 11ккал/моль |
| Поверхностная электропроводность, ом—1 |
10—10 (—11°C) | Кажущаяся энергия активации 32ккал/моль |
| Модуль Юнга, дин/см | 9·1010 (—5°C) | Поликристаллич. лёд |
| Сопротивление, Мн/м2 : раздавливанию разрыву срезу |
2,5 1,11 0,57 |
Поликристаллический лёд Поликристаллический лёд Поликристаллический лёд |
| Средняя эффективная вязкость, пз | 1014 | Поликристаллический лёд |
| Показатель степени степенного закона течения |
3 |
|
| Энергия активации при деформировании и механической релаксации, ккал/моль |
11,44—21,3 | Линейно растет на 0,0361 ккал/(моль·°C) от 0 до 273,16 К |
Примечание. 1 кал/(г×°С)=4,186 кджl (kг (К); 1 ом-1×см-1=100 сим/м; 1 дин/см=10-3 н/м; 1 кал/(см (сек×°С)=418,68 вт/(м (К); 1 пз=10-1 н (сек/м2.
Табл. 2. — Количество, распространение и время жизни льда 1
| Вид льда | Масса | Площадь распространения | Средняя концен | Скорость прироста массы, г/год | Среднее время жизни, год | ||
| г | % | млн. км2 | % | ||||
| Ледники | 2,4·1022 | 98,95 | 16,1 | 10,9 суши | 1,48·105 | 2,5·1018 | 9580 |
| Подземный лёд | 2·1020 | 0,83 | 21 | 14,1 суши | 9,52·103 | 6·1018 | 30—75 |
| Морской лёд | 3,5·1019 | 0,14 | 26 | 7,2 океана | 1,34·102 | 3,3·1019 | 1,05 |
| Снежный покров | 1,0·1019 | 0,04 | 72,4 | 14,2 Земли | 14,5 | 2·1019 | 0.3—0,5 |
| Айсберги | 7,6·1018 | 0,03 | 63,5 | 18,7 океана | 14,3 | 1,9·1018 | 4,07 |
| Атмосферный лёд | 1,7·1018 | 0,01 | 510,1 | 100 Земли | 3,3·10—1 | 3,9·1020 | 4·10—3 |
В связи с широким распространением воды и льда на земной поверхности резкое отличие части свойств льда от свойств др. веществ играет важную роль в природных процессах. Вследствие меньшей, чем у воды, плотности лёд образует на поверхности воды плавучий покров, предохраняющий реки и водоёмы от промерзания до дна. Зависимость между установившейся скоростью течения и напряжением у поликристаллического льда гиперболическая; при приближённом описании её степенным уравнением показатель степени увеличивается по мере роста напряжения; кроме того, скорость течения прямо пропорциональна энергии активации и обратно пропорциональна абсолютной температуре, так что с понижением температуры лёд приближается к абсолютно твёрдому телу. В среднем при близкой к таянию температуре текучесть льда в 106 раз выше, чем у горных пород. Благодаря текучести лёд не накопляется беспредельно, а стекает с тех частей земной поверхности, где его выпадает больше, чем стаивает (см. Ледники). Вследствие очень высокой отражательной способности льда (0,45) и особенно снега (до 0,95) покрытая ими площадь — в среднем за год около 72 млн. км2 в высоких и средних широтах обоих полушарий — получает солнечного тепла на 65% меньше нормы и является мощным источником охлаждения земной поверхности, чем в значительной мере обусловлена современная широтная климатическая зональность. Летом в полярных областях солнечная радиация больше, чем в экваториальном поясе, тем не менее температура остаётся низкой, т. к. значительная часть поглощаемого тепла затрачивается на таяние льда, имеющего очень высокую теплоту таяния.
Льды II, III и V длительное время сохраняются при атмосферном давлении, если температура не превышает —170°С. При нагревании приблизительно до —150°С они превращаются в кубический лёд (лёд Ic), не показанный на диаграмме, т. к. неизвестно, является ли он стабильной фазой. Др. способ получения льда Ic — конденсация водяных паров на охлажденную до —120°С подложку. При конденсации паров на более холодной подложке образуется аморфный лёд. Обе эти формы льда могут самопроизвольно переходить в гексагональный лёд I, причём тем скорее, чем выше температура.
Лёд IV является метастабильной фазой в зоне устойчивости льда V. Ллёд IV легче образуется, а возможно и стабилен, если давлению подвергается тяжёлая вода. Кривая плавления льда VII исследована до давления 20 Гн/м2 (200 тыс. кгс/см2). При этом давлении лёд VII плавится при температуре 400°С. Лёд VIII является низкотемпературной упорядоченной формой льда VII. Лёд IX — метастабильная фаза, возникающая при переохлаждении льда III и по существу представляющая собой низкотемпературную его форму. Вообще явления переохлаждения и метастабильные равновесия очень характерны для фаз, образуемых водой. Некоторые из линий метастабильных равновесий обозначены на диаграмме пунктиром.
Полиморфизм льда был обнаружен Г. Тамманом (1900) и подробно изучен П. Бриджменом (начиная с 1912). С 60-х гг. фазовая диаграмма воды, полученная Бриджменом, несколько раз дополнялась и уточнялась. В табл. 3 и 4 приведены некоторые данные о структурах модификаций льда и некоторые их свойства.
Кристаллы всех модификаций льда построены из молекул воды H2O, соединённых водородными связями в трёхмерный каркас (рис. 2). Каждая молекула участвует в 4 таких связях, направленных к вершинам тетраэдра. В структурах льда I, Ic, VII и VIII этот тетраэдр правильный, т. е. угол между связями составляет 109°28'. Большая плотность льда VII и VIII объясняется тем, что их структуры содержат по 2 трёхмерные сетки водородных связей (каждая из которых идентична структуре льда Ic), вставленные одна в другую. В структурах льда II, III, V и VI тетраэдры заметно искажены. В структурах льда VI, VII и VIII можно выделить 2 взаимоперекрещивающиеся системы водородных связей. Данные о положениях протонов в структурах льда менее определенны, чем атомов кислорода. Можно утверждать, что конфигурация молекулы воды, характерная для пара, сохраняется и в твёрдом состоянии (по-видимому, несколько удлиняются расстояния О — Н вследствие образования водородных связей), а протоны тяготеют к линиям, соединяющим центры атомов кислорода. Т. о. возможны 6 более или менее эквивалентных ориентаций молекул воды относительно их соседей. Часть из них исключается, поскольку нахождение одновременно 2 протонов на одной водородной связи маловероятно, но остаётся достаточная неопределённость в ориентации молекул воды. Она осуществляется в большинстве модификаций льда — I, III, V, VI и VII (и по-видимому в Ic), так что, по выражению Дж. Бернала, Лёд кристалличен в отношении атомов кислорода и стеклообразен в отношении атомов водорода. Во льдах II, VIII и IX молекулы воды ориентационно упорядочены.
Табл. 3. — Некоторые данные о структурах модификаций льда
| Модифи | Сингония | Фёдоровская группа | Длины водородных связей, | Углы О—О—О в тетраэдрах |
| I Ic II III V VI VII VIII IX | Гексагональная Кубическая Тригональная Тетрагональная Моноклинная Тетрагональная Кубическая Кубическая Тетрагональная | P63/mmc F43m R3 P41212 A2/a P42/nmc Im3m Im3m P41212 | 2,76 2,76 2,75—2,84 2,76—2,8 2,76—2,87 2,79—2,82 2,86 2,86 2,76—2,8 | 109,5 109,5 80—128 87—141 84—135 76—128 109,5 109,5 87—141 |
Примечание. 1 A=10-10 м.
Табл. 4. — Плотность и статическая диэлектрическая проницаемость различных льдов
| Модификация | Темп-ра, °С | Давление, Мн/м2 | Плотность, г/см2 | Диэлектрическая проницаемость |
| I Ic II III V VI VII VIII IX | 0 —130 —35 —22 —5 15 25 —50 —110 | 0,1 0,1 210 200 530 800 2500 2500 230 | 0,92 0,93 1,18 1,15 1,26 1,34 1,65 1,66 1,16 | 94 — 3,7 117 144 193 ~150 ~3 ~4 |
Лёд в атмосфере, в воде, на земной и водной поверхности и в земной коре оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Он может вызывать ряд стихийных явлений с вредными и разрушительными последствиями (обледенение летательных аппаратов, судов, сооружений, дорожного полотна и почвы, градобития, метели и снежные заносы, речные заторы и зажоры с наводнениями, ледяные обвалы, разрыв корней растений при образовании слоев льда в почве и др.). Прогнозирование, обнаружение, предотвращение вредных явлений, борьба с ними и использование льда в различных целях (снегозадержание, устройство ледяных переправ, изотермических складов, облицовка хранилищ, льдозакладка шахт и т.п.) представляют предмет ряда разделов гидрометеорологических и инженерно-технических знаний (ледотехника, снеготехника, инженерное мерзлотоведение и др.), деятельности специальных служб (ледовая разведка, ледокольный транспорт, снегоуборочная техника, искусственное сбрасывание лавин и т.д.). Для некоторых видов спорта используются катки с искусственным охлаждением, позволяющие проводить соревнования на льду в тёплое время года и в закрытом помещении. Природный лёд используется для хранения и охлаждения пищевых продуктов, биологических и медицинских препаратов, для чего он специально производится и заготавливается (см. Ледник, Льдопроизводство).
Лит.: Шумский П. А., Основы структурного ледоведения, М., 1955; Паундер Э. Р., Физика льда, пер. с англ., М., 1967; Eisenberg D., Kauzmann W., The structure and properties of water, Oxf., 1969; Fletcher N. H., The chemical physics of ice, Camb., 1970.
Г. Г. Маленков.
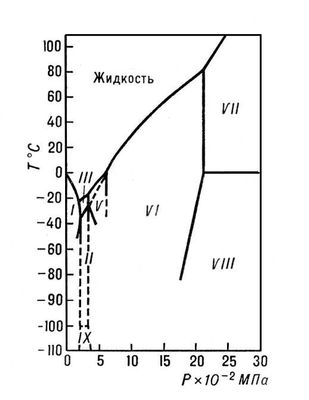
Рис. 1. Фазовая диаграмма воды.
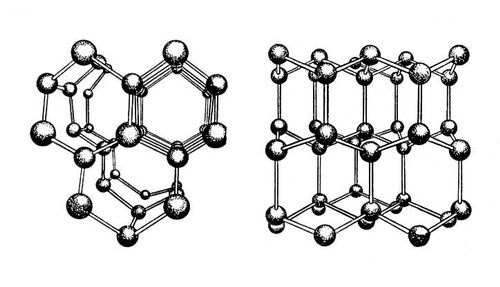
Рис. 2. Схема структуры льда I (показаны атомы кислорода и направления водородных связей) в двух проекциях.