Интерметаллиды
ИНТЕРМЕТАЛЛИДЫ (от лат. inter - между и металл) (интерметаллич. соединения), хим. соед. двух или неск. металлов между собой. Относятся к металлическим соединениям, или металлидам. Интерметаллиды образуются в результате взаимод. компонентов при сплавлении, конденсации из пара, а также при р-циях в твердом состоянии вследствие взаимной диффузии (при химико-термич. обработке), при распаде пересыщенного твердого раствора одного металла в другом, в результате интенсивной пластич. деформации при мех. сплавлении (механоактивации). Для интерметаллидов характерны преим. металлич. тип хим. связи и специфич. металлич. св-ва. Однако среди интерметаллидов имеются также солеобразные соед. с ионной связью (т. наз. валентные соед., образующиеся из элементов разл. хим. природы и представляющие собой стехиометрич. соед.), напр. NaAu, соед. с промежут. характером связи - ионно-металлич. и ковалентно-металлической, а также с ковалентной. Так, в ряду соед. Mg с элементами подгруппы IVa вместе с уменьшением различия в электрохим. характеристиках компонентов наблюдается и изменение св-в интерметаллидов - от характерных для ионных соед. (Mg2Si, Mg2Ge) к св-вам, типичным для металлов (Mg2Pb). В соед. структурного типа NiAs (рис. 1) или родственных типов Ni2In, NiTe2 или CdI2, представляющих собой соед. переходных металлов подгрупп VIIб, VIIIб и металлов подгруппы Сu с элементами подгрупп IIIa-VIa (т. наз. никель-арсенидные фазы, или фазы Макарова), сложная природа хим. связи, к-рая изменяется с изменением положения компонентов в периодич. системе; одновременно изменяется и состав интерметаллидов. Для соед. состава АВ характерна ковалентно-металлич. связь; при изменении состава интерметаллидов от АВ2 (напр., NiTe2) до А2В (напр., Ni2In) наблюдается изменение природы связи - от преобладающей ионно-ковалентной до металлической.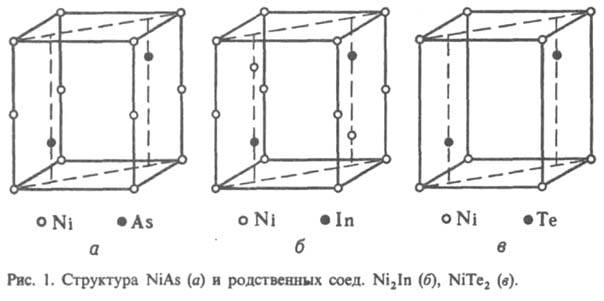
Среди двойных интерметаллидов наиб. распространены соед. Курнакова, фазы Лавеса, фазы Юм-Розери (электронные соед.), s-фазы, s-подобные фазы. Известны и нек-рые др. интерметаллиды. Особенно многочисленными являются соед. Курнакова (сверхструктуры, упорядоченные твердые р-ры), характеризующиеся упорядоченным расположением атомов компонентов (атомы каждого из металлов занимают в кристаллич. решетке интерметаллидов строго определенное положение, создавая как бы неск. вставленных одна в другую подрешеток).
Кристаллическая структура. Классификация интерметаллидов по кристаллич. структурным типам плохо коррелирует с типами хим. связи, т. к. одни и те же структуры м. б. у соед. с разл. природой хим. связи. Можно лишь выделить структуры с низкими координац. числами (к. ч.), характерные для интерметаллидов с ковалентной связью. При этом атомы элемента из подгрупп б периодич. системы в структуре типа СаF2 расположены внутри тетраэдра (к. ч. = 4, напр., PtAl2, AuIn2), а в структуре типа NiAs - в центре тригональной призмы (к. ч. = 6). Структуры ионных и металлич. кристаллов можно рассматривать как плотные упаковки сферич. частиц (см. Плотная упаковка). Благодаря плотной упаковке одни и те же структурные типы характерны для кристаллов с ионным и металлич. типом связи. Главный параметр, определяющий возникновение того или иного структурного типа для ионных и металлич. кристаллов, - отношение соотв. ионных и металлич. радиусов компонентов. Ограничение числа реализующихся структурных типов для интерметаллидов связано с тем, что диапазон изменений металлич. атомных радиусов существенно уже, чем диапазон изменений радиусов катионов и анионов в ионных соединениях. Вместе с тем среди интерметаллидов, как и среди металлов, имеются специфич. кристаллич. структуры. Предложенный Л. Полингом метод описания структуры ионных кристаллов с помощью координац. полиэдров используют и для описания структур интерметаллидов. Напр., легко устанавливается родственность интерметаллидов трех структурных типов фаз Лавеса (усеченные тетраэдры) MgCu2, MgZn2 и MgNi2 (рис. 2). В основе наиб. общей систематики структурных типов интерметаллидов (П. И. Крипякевич, 1963) лежат координац. характеристики атома меньшего размера. Всего выделено 14 классов (или семейств) структурных типов, главные из них указаны в табл. 1.
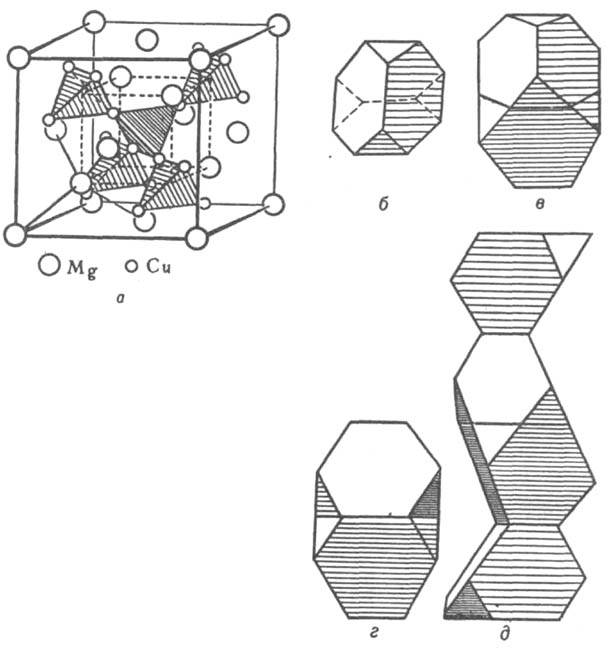
Рис. 2. Структура фаз Лавеса: a - MgCu2. Атомы Mg образуют подрешетку со структурой типа алмаза. Атомы Сu расположены в пустотах (порах) этой подрешетки, образуя тетраэдры (показаны крупной штриховкой); центры этих тетраэдров совпадают с центрами тетраэдрич. пор подрешетки атомов Mg. Соединения вершин соседних тетраэдров также образуют тетраэдр (показан мелкой штриховкой); это позволяет представить расположение атомов непрерывной вязью тетраэдров по всему кристаллу, что справедливо для всех типов фаз Лавеса; б - полиэдр Лавеса - усеченный тетраэдр; в, г, д - изображения структурных типов фаз Лавеса в полиэдрах соотв. MgCu2, MgZn2, MgNi2.
К числу наиб. распространенных относятся интерметаллиды, имеющие структуры, близкие к структурам чистых металлов, - плотнейшие кубич. гранецентрированную и гексагональную (к. ч. = 12), а также кубич. объемноцентрированную (к. ч. = 8 + 6, где 8 и 6 - число атомов соотв. в первой и второй координац. сферах). Координац. многогранники для плотнейших упаковок шаров одинакового размера - кубооктаэдр и его гексагон. аналог (рис. 3, а, б) - характерны для интерметаллидов, компоненты к-рых имеют близкие атомные радиусы. Кроме соед. со структурами типов Сu и Mg к данному классу принадлежат семейства сверхструктур (напр., AuCu, AuCu3, Pt7Cu), а также структурные типы Ni3Sn, TiCu3 и др. К. ч. = 8 + 6 соответствует координац. многогранник в виде куба (8 соседей у центр. атома), атомы второй координац. сферы располагаются в вершинах октаэдра. К этому классу относятся структурные типы a-Fe, сверхструктуры на основе решетки типа a-Fe (напр., b-латунь или CuZn, Fe3Al).

Др. подход к систематике кристаллич. структур металлов и их сплавов основан на выявлении наиб. характерных плотных и плоских (или почти плоских) сеток и последовательностей их укладки (У. Пирсон, 1972).
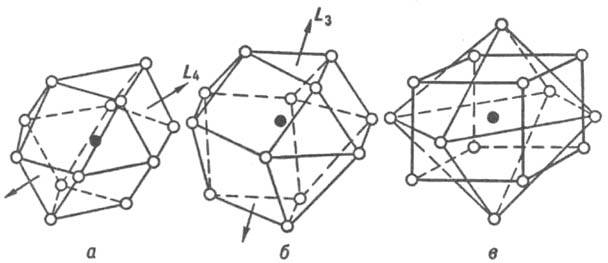
Рис. 3. Наиб. распространенные координационные многогранники для интерметаллидов: а - кубооктаэдр, к. ч. = 12 (гранецентрир. кубич. структура); б - гексагональный аналог кубооктаэдра, к. ч. = 12 (гексагон. плотноупакованная структура); в - куб, к. ч. = 8, и октаэдр, к. ч. = 6 (объемноцентрированная кубич. структура). Атом в центре координац. многогранника показан черным кружком, атомы в вершинах - светлыми, принадлежат первой координац. сфере (а, б) или первой и второй (в).
Примерно половина всех известных структурных типов металлич. и полупроводниковых соед. описываются укладкой правильных атомных треугольных (36), гексагональных (63) сеток, сеток кагомэ (3636) и сеток (32434), содержащих квадраты (рис. 4; в обозначениях сеток большие цифры указывают форму ячейки, напр. 3 - треугольная, 4 - квадрат и т.д., цифры в верх. индексах - число таких ячеек, окружающих узел сетки).
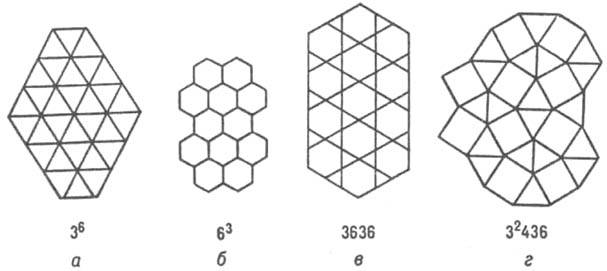
Рис. 4. Структуры интерметаллидов, изображенные атомными сетками.
Известные решетки металлов - гексагональная плотноупакованная и кубич. гранецентрированная - представляют собой двух- (ABA...) и трехслойные (АВСА...) упаковки треугольных сеток 36; в структурах соед. сетки содержат атомы разного сорта с упорядоченным или неупорядоченным расположением, м. б. искаженными и иметь пятиугольные ячейки. В качестве примера на рис. 5 представлена структура s-фазы, показанная сетками.
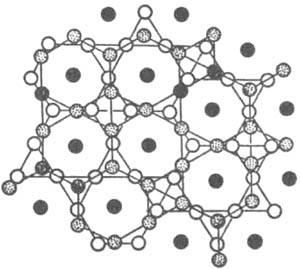
Рис. 5. Структура s-фазы; представлена двумя сетками кагоме, повернутыми одна по отношению к другой на 90°; атомы, находящиеся между этими сетками, обозначены черными кружками.
Несмотря на удобство описания мн. структур с помощью плоских атомных сеток, следует учитывать трехмерный характер координации атомов в структурах кристаллов интерметаллидов. Одним из главных принципов структурообразования для этих кристаллов следует считать предложенный Ф. Лавесом в 1967 принцип наиб. полного заполнения пространства, к-рое обеспечивается или плотнейшей упаковкой сфер при одинаковом радиусе компонентов (к. ч. = 12; поры, или пустоты, между атомами имеют конфигурацию тетраэдров и октаэдров), или идеальной упаковкой неск. искаженных тетраэдров (характеризуется только одним типом пор - тетраэдрическим).
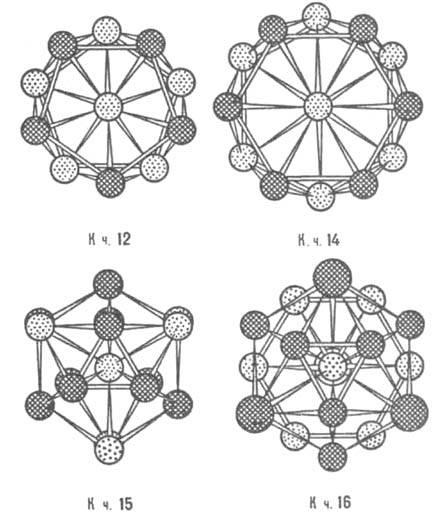
Рис. 6. Координационные многогранники Каспера - Франка; показаны проекциями атомов на плоскость чертежа; атомы, находящиеся на разных уровнях по отношению к центральному, изображены разл. способами.
Дж. Каспер и Ф. Франк в 1958 нашли 4 типа сложенных из тетраэдров выпуклых многогранников с треугольными гранями, имеющих 12, 14, 15 и 16 вершин (рис. 6). Эти многогранники (как взаимопроникающие) описывают сложные атомные структуры нек-рых металлич. элементов (напр., a-Mn) и ряда интерметаллидов (напр., s-фаз). Для большинства интерметаллидов, описываемых многогранниками Каспера -Франка, характерно небольшое различие атомных радиусов. В др. случаях, напр., для фаз Лавеса, условия плотной упаковки требуют обязательного и существ. различия величин атомных радиусов компонентов интерметаллида. Состав и структура интерметаллидов зависят от электроотрицательности компонентов, числа валентных электронов, величин атомных (металлич. или ковалентных) или ионных радиусов (в зависимости от преобладающего типа хим. связи), т.е. в целом от положения компонентов в периодич. системе. Главный фактор, определяющий состав и строение фаз Юм-Розери, - электронная концентрация nэл, равная отношению числа валентных электронов к числу атомов в решетке интерметаллида (табл. 2). Структуры этих интерметаллидов повторяют характерные структуры металлов. Для двойных интерметаллидов установлены след. типы электронных соед.: в области значений пэл ок. 3/2 образуются b-фазы Юм-Розери структурных типов b-латуни, CsCl, b-Mn, Mg; ок. nэл = 21/13 - g-фазы со структурой типа g-латуни; ок. пзл = 7/4 - e-фазы структурного типа e-латуни. Значения nэл соответствуют границам области гомогенности (для компонента в более высокой степени окисления) данной фазы. Др. случай проявления ограничивающего действия фактора электронной концентрации известен для трехкомпонентных систем, напр., для MgCu2 -MgAl2, когда замещение меди алюминием приводит к последовательной смене структурных типов от MgCu2 (nэл = 1,33-1,73) к MgNi2 (nэл= 1,81-1,95) и к MgZn2 (nэл = 1,98-2,05).
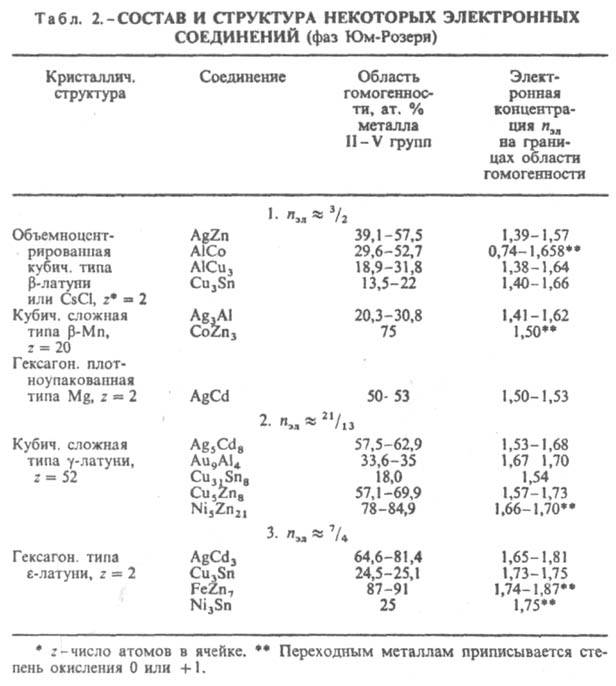
Ограничивающее действие фактора электронной концентрации сказывается при образовании s-фаз, возникающих в сплавах металлов подгрупп Vб-VIIб с металлами подгруппы VIIIб. s-Фазы имеют частично или полностью упорядоченное расположение атомов в решетке типа b-U и отличаются одинаковой электронной концентрацией (ns+d = 6,7-7,2, где ns+d - отношение суммы s- и d-электронов к числу атомов в решетке). Состав s-фазы в системе V-Fe близок к АВ3 (17-28% V), в системе V-Ni - к А2В (55-65 ат.% V). В двух- и особенно в трехкомпонентных системах фактор электронной концентрации проявляется в определенной последовательности смены s- и s-подобных фаз (s : Р : m : R : c) с изменением состава. Во всех рассмотренных случаях сопоставляются структуры с одинаковыми или близкими координацией и компактностью кристаллич. решетки (типичные металлич. структуры в случае фаз Юм-Розери, одинаковая координация в случае s-подобных фаз). При сравнении ряда структур с существенно разл. координациями и компактностью должен быть др. подход к количеств. оценке фактора электронной концентрации. В случае интерметаллидов, образуемых элементами подгрупп б, удалось установить (В. Ф. Дегтярева, Ю. А. Скаков, 1976) связь последовательности смены структур (в одной или в разных системах) с изменением состава при определении электронной концентрации как отношения числа валентных электронов к единице объема (табл. 3). Необходимость такого способа выражения электронной концентрации обусловлена тем, что в отличие от ряда фаз Юм-Розери в ряду соед. металлов подгрупп б сильно изменяются компактность решеток и к. ч. В случае др. интерметаллидов электронный фактор может не оказывать ограничивающего действия на концентрац. область существования интерметаллидов, т.к. ограничивающим становится др. фактор -геометрический (или размерный) rА/rВ, - требующий определенного соотношения числа атомов компонентов в связи с особой ролью атомного упорядочения, напр. соед. Ni4Mo, или в связи с тем, что позиции, занимаемые атомами в кристаллич. решетке, не равноценны, напр., фазы Лавеса АВ2.
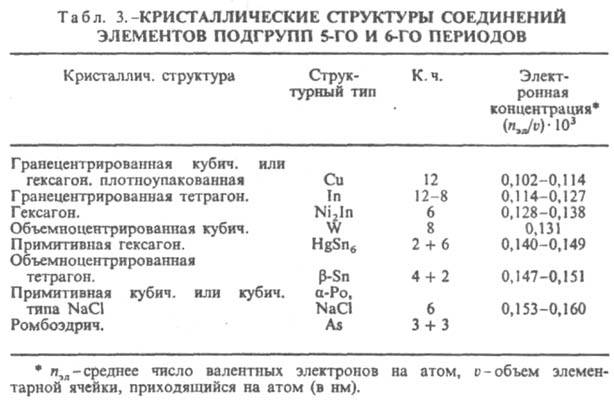
Эти фазы (структурные типы MgCu2 - кубич., MgNi2 - гексагон. и MgZn2 - гексагон.) возникают при взаимод. металлов практически всех групп периодич. системы при условии, что соотношение атомных радиусов компонентов rА/rВ ~ 1,22 (практически для табличных значений радиусов rА/rВ ~ 1,10-1,40). Ограничивающее действие фактора электронной концентрации проявляется в том, что нек-рые элементы вообще не образуют фаз Лавеса, напр., переходные элементы в системах состава АВ2 при ns+d [ 7,7. При анализе возможности образования того или иного интерметаллида исходят не из конкретных значений геом. факторов и эффективных атомных радиусов, а из табличных для к. ч. = 12; в случае переходных металлов следует иметь в виду, что их атомные радиусы сравнительно мало изменяются в пределах одного периода, поскольку при переходе от элемента к элементу достраиваются внутр. электронные оболочки. Благодаря эффекту лантаноидного сжатия малы различия атомных радиусов элементов 5-го и 6-го периодов, 24 элемента имеют атомные радиусы в пределах 0,125-0,160 нм, и различия между ними составляют 10% и менее. Влияние геом. фактора на состав и структуру интерметаллидов наблюдается при переходе от фаз Лавеса АВ2 к соед. АВ5 (или АВn). Если в соед. АВ2 один из атомов А (имеет больший радиус) из каждых двух формульных единиц в ячейке кристаллич. решетки замещается атомом В, возникают интерметаллиды состава АВ5, напр. АuВе5 (структурный тип MgCu2) или СаСu5 (структурный тип MgZn2). Дальнейшее замещение в структуре типа СаСu5 1/3 или 1/2 атомов А парами менее крупных атомов приводит к структурным типам Th2Ni17 и ThMn12; при этом чем больше отношение rА/rВ, тем больше п в ф-ле АВn. Ряд таких интерметаллидов образуется в системе Co-Sm и в др. подобных системах, содержащих РЗЭ. При взаимод. Ti, Sc, Hf, Zr с переходными элементами VIII гр.- Ni, Co, Pd, Rh, Pt - возникают фазы А2В, близкие по структуре к т. наз. карбиду быстрорежущей стали Fe3W3C (кубич. структура, 96 атомов в ячейке); геом. фактор rА/rВ ~ 1,20 (к. ч. = 12), однако на образование этих фаз оказывает ограничивающее действие и фактор электронной концентрации, чем объясняется отсутствие двойных фаз с участием Fe. С этим же фактором, вероятно, надо связывать появление таких фаз в ряде систем при наличии кислорода, азота или углерода, к-рые выступают как стабилизаторы (подобно фазам внедрения). В тройных системах образуются интерметаллиды, имеющие как отличия, так и сходства в структурных типах с двойными интерметаллидами. Напр., Сu2АlМn по структурному типу (кубич. сингония, 16 атомов в ячейке) близок к Fe3Al; элементарная ячейка кристаллич. решетки s-подобной Р-фазы в трехкомпонентном сплаве Cr18Mo42Ni40 (ромбич. сингония, 56 атомов в ячейке) м. б. описана как сдвоенная по оси с ячейка решетки s-фазы. Вместе с тем добавление третьего (или четвертого) компонента в систему часто приводит к появлению новых, не существовавших в данной двойной системе интерметаллидов в связи с действием фактора электронной концентрации (напр., образование а-фазы в системе Cr-Ni при добавлении 8-15% Si). Найден особый тип интерметаллидов, в к-рых отсутствует трансляционная симметрия кристалла, поскольку существует ось симметрии 5-го порядка. Эти соед. наз. квазикристаллич. (см. Квазикристалл), или икосаэдрическими. Впервые такое соед. было получено как метастабильная фаза в системе Аl-Мn при содержании ок. 16 ат.% Мn в условиях закалки из жидкого состояния. Для ряда сплавов в области концентраций, где образуются интерметаллиды, в условиях большой скорости охлаждения расплава получают метастабильные аморфные фазы, или металлич. стекла (напр., в системах Cu-Zr, Ni-Ti). Аморфные интерметаллиды возможно получить также при конденсации из пара, сильной деформацией смеси порошков, при ионной имплантации или путем радиац. воздействия на интерметаллиды.
Свойства. Физ. и хим. св-ва интерметаллидов в гораздо большей степени, чем кристаллич. структура, зависят от природы хим. связи. Ионные интерметаллиды обладают св-вами, характерными для солей, -высокой т-рой плавления, пониженной (по сравнению с металлической) электрич. проводимостью, наличием на диаграммах состояния узких областей гомогенности и др., многие разлагаются водой. Для интерметаллидов с преобладающей металлич. связью характерны св-ва металлов, прежде всего более или менее значит. способность к пластич. деформации. Все же мн. интерметаллиды отличаются низкой пластичностью и сообщают повыш. хрупкость сплавам, в к-рых они являются одной из структурных составляющих (напр., фаза s-FeCr в хромистых сталях) или основой (напр., SmCo5 в сплаве для постоянных магнитов). Благодаря особенностям кристаллич. и электронной структур интерметаллидов в них происходит как бы оптимизация важных в практич. отношении физ. св-в (высокая т-ра плавления и низкая диффузионная подвижность компонентов в жаропрочных сплавах, магнитокристаллич. анизотропия и высокая коэрцитивная сила в сплавах для постоянных магнитов, нулевая магнитострикция и высокая магн. проницаемость в магнитно-мягких сплавах, сверхпроводимость, напр., в сплавах Nb3Sn, Nb3Al и др.). Св-вами полупроводников обладают, как правило, соед. металлов с неметаллами. В связи с использованием интерметаллидов для получения высокопрочных сплавов, в т.ч. коррозионно- и жаростойких, жаропрочных, важны хим. св-ва интерметаллидов, особенно их отношение к окислению. При окислении тугоплавких интерметаллидов при низких т-рах в связи с малой подвижностью атомов в решетках могут образовываться как простые оксиды, так и сложные (напр., Nb2O5.Al2O3 при окислении NbAl3), они м. б. кристаллич., аморфными или метастабильной кристаллич. структуры. Образование поверхностных оксидных пленок повышает сопротивляемость интерметаллидов к окислению. Наиб. стойки к окислению при повыш. т-рах (выше 1000 °С) алюминиды и бериллиды. Ряд интерметаллидов, в частности интерметаллиды щелочных и щел.-зем. металлов и нек-рые соед. Аl, разлагаются в присут. влаги. Скорость разложения легкоплавких интерметаллидов возрастает в ходе р-ции (20-40 ч); MgCu2, MgZn2, Al3Mg2, CuAl2 влагой не разлагаются. Характер взаимод. интерметаллидов с Н2 зависит от реакц. способности компонентов по отношению к водороду. Если все компоненты интерметаллида являются активными гидридообразователями, происходит диссоциация интерметаллида с образованием индивидуальных гидридов, насыщение водородом может привести к аморфизации интерметаллида. В др. случаях возникают сложные гидриды как фазы на основе интерметаллида (см. Гидриды). Это определяется не только особенностями кристаллич. структуры (напр., наличием мест внедрения), но и особенностями электронной структуры компонентов и самого интерметаллида (наличием электронных вакансий). Такими особенностями обладают фазы Лавеса, а также родственные им фазы с участием переходных металлов, прежде всего РЗЭ.
Применение. Нек-рые интерметаллиды используют как магн. материалы (SmCo5, Fe3Ni, Cu2MnAl и др.), сверхпроводники (Nb3Sn и др.), аккумуляторы Н2 (соед. РЗЭ, РЗЭ и Mg, напр. LaNi5, CeMg12). Интерметаллиды входят в состав высокопрочных конструкц. материалов (напр., обеспечивают высокую прочность в дисперсионно-твердеющих сплавах на основе Al, Cu, Fe и др.), жаропрочных сплавов [напр., g'-Ni3 (Al, Ti) в сплавах на основе Ni создает высокодисперсную микроструктуру, сохраняющую высокую прочность в условиях длительной работы при повыш. т-рах]. На основе интерметаллидов созданы защитные покрытия из тугоплавких металлов (Ni3Al, Ni3Nb, Ti3Al и др.). Фазовое превращ. TiNi (кубич. D ромбич. фаза) обусловливает специфич. св-во этого материала - "память формы"; TiNi используют для изготовления термочувствит. элементов и преобразователей тепловой энергии в механическую. Литература
