Кристаллическая структура
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА, расположение атомов кристаллич. в-ва в пространстве. наиб. характерное св-во кристаллической структуры - трехмерная периодичность (см. Кристаллическое состояние). Обычно, говоря о кристаллической структуре, подразумевают среднее во времени расположение атомных ядер (т. наз. статич. модель); более полная информация включает сведения об амплитудах и частотах колебаний атомов (динамич. модель), а также о распределении электронной плотности в межъядерном пространстве. Изучение кристаллических структур и их связи со св-вами в-в составляет предмет кристаллохимии. Геом. характеристики кристаллической структуры, данные о распределении электронной плотности, амплитуды колебаний атомов (точнее, среднеквадратичные смещения от положений равновесия) находят с помощью дифракционных методов исследования (рентгеноструктурного анализа, нейтронографии и электронографии кристаллов), частоты колебаний - методами спектроскопии (ИК, комбинац. рассеяния, неупругого рассеяния нейтронов). Моделирование кристаллической структуры. Идеальная кристаллическая структура характеризуется бесконечной пространств. решеткой, т.е. состоит из идентичных элементарных ячеек. Последние имеют форму параллелепипедов со сторонами а, b, с и углами a, b, g (параметры решетки) и соприкасаются целыми гранями. В реальных кристаллах кристаллическая структура всегда искажена дефектами, а также наличием пов-сти кристалла. Иногда вместо термина "кристаллическая структура" употребляют термин "кристаллич. решетка"; предпочтительнее, однако, придавать последнему иное содержание (см. Кристаллы). Чтобы описать статич. модель кристаллической структуры, необходимо указать ее симметрию, выражаемую одной из пространственных (федоровских) групп, параметры решетки и координаты атомных ядер в ячейке; эти данные позволяют вычислить межатомные расстояния и валентные углы. Первичная трактовка такой модели при наличии между атомами ковалентных связей состоит в том, что атомы соединяют валентными штрихами в соответствии с классич. теорией хим. строения. Межатомные расстояния указывают правильный способ проведения валентных штрихов: обычно расстояние А — В, соответствующее ковалентной связи, существенно короче, чем кратчайшее расстояние между валентно не связанными атомами А и В. Если ковалентные связи отсутствуют (превалируют ионные, металлич. или ван-дер-ваальсовы межатомные взаимод.), модель кристаллической структуры представляют в виде плотной упаковки, образованной шарами одинакового размера (простые в-ва) или шарами неск.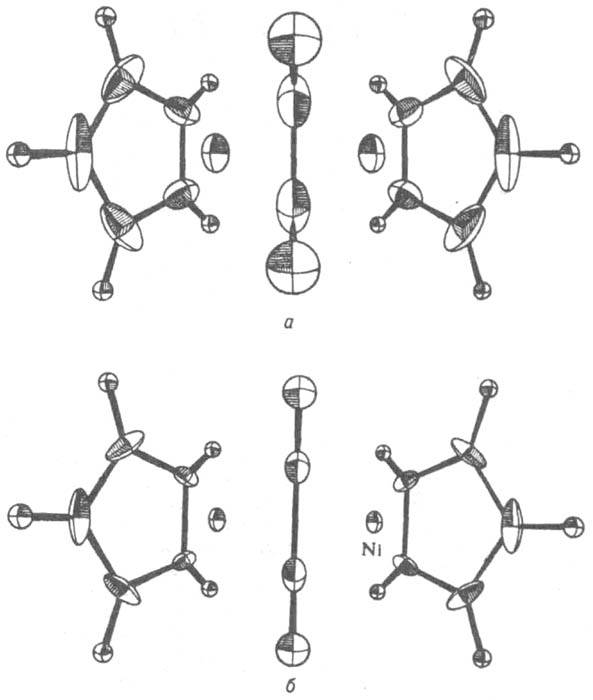
Рис. 1. Эллипсоиды тепловых колебаний атомов в структуре m-ацетилен-бис(циклопентадиенникеля) при 300 К (а) и 77 К (6). В центре молекула ацетилена, по бокам - молекулы циклопентадиена.
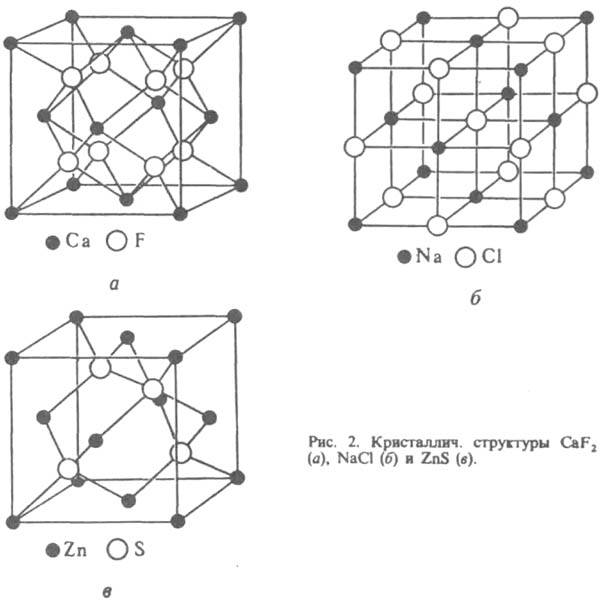
сортов (напр., анионы образуют упаковку, катионы располагаются в ее пустотах). Учет трехмерного распределения электронной плотности р в пространстве декартовых координат х, у, z приводит к модели кристаллической структуры, согласно к-рой атомные ядра "погружены" в непрерывно распределенный с плотностью р электронный заряд. Совр. прецизионный рентгеноструктурный анализ позволяет экспериментально изучать особенности ф-ции r(х, у, z) и определять изменение электронной плотности атомов в кристалле в сравнении с электронной плотностью r0 валентно не связанных атомов, получаемой в результате квантовохим. расчетов. Эти данные м. б. полезны для установления областей локализации валентных и неподеленных электронных пар, для обнаружения переноса заряда и др. особенностей строения в-в с ковалентными связями, а также в-в, в к-рых направленные межатомные взаимод. отсутствуют. Для отражения динамики атомов в кристаллической структуре в гармонич. приближении атомы изображают в виде "тепловых эллипсоидов", к-рые имеют след. физ. смысл: с фиксир. вероятностью р в любой момент времени атомное ядро находится внутри или на пов-сти такого эллипсоида (рис. 1). Направление наиб. вытянутости эллипсоида соответствует направлению, в к-ром атом совершает максимальные по амплитуде колебания, направление наиб. сжатия соответствует минимальным по размаху колебаниям. Обычно производят нормировку на вероятность р=1/2. При данной р размеры эллипсоидов зависят от т-ры. Чтобы количественно охарактеризовать форму и ориентацию атомных тепловых эллипсоидов, для каждого атома указывают 6 независимых компонентов симметричного тензора 2-го ранга, значения к-рых определяют по данным рентгеноструктурного исследования. Описанная динамич. модель не дает сведений о мгновенной структуре кристалла и о последоват. смене мгновенных структур. Информацию такого рода можно получить из спектров неупругого рассеяния нейтронов. Классификация кристаллических структур. В принципе каждому кристаллич. в-ву присуща своя структура. Однако часто разные в-ва имеют кристаллические структуры, одинаковые с точностью до подобия (т. наз. изоструктурность). Иногда такие в-ва способны образовывать смешанные кристаллы (см. Изоморфизм). С др. стороны, одно и то же хим. соед. в разных термодинамич. условиях и при разных способах получения может иметь разные кристаллические структуры (см. Полиморфизм). Кристаллические структуры очень многообразны - от простых (напр., у алмаза) до чрезвычайно сложных (напр., у бора). Изучены кристаллические структуры неск. десятков тысяч в-в, включая белки и др. сложные прир. соед. Для неск. сотен кристаллич. в-в (как неорг., так и орг.) изучено распределение электронной плотности в кристаллах. Кристаллические структуры делят нагомодесмические (координационные) и гетеродесмические. В первых все атомы соединены одинаковыми хим. связями, образующими пространств. каркас (напр., алмаз, галогениды щелочных металлов). Для вторых характерно наличие структурных фрагментов, внутри к-рых атомы соединены наиб. прочными (чаще всего ковалентными) связями; атомы, принадлежащие разл. фрагментам, связаны существенно слабее. Фрагменты могут представлять собой конечные группировки атомов ("острова"), цепи, слои, каркасы; соотв. выделяют островные, цепочечные, слоистые и каркасные кристаллические структуры. Островными кристаллическими структурами обладают почти все орг. соед., а также галогены, О2, S, (NH4)2SO4 и др. Роль островов играют молекулы (см. Молекулярные кристаллы) или многоатомные ионы. Цепочечную кристаллическую структуру имеет, напр., одна из модификаций Se, в к-рой атомы связаны в бесконечные спирали. Слоистое строение имеют графит, BN, MoS2 и др. Пример каркасной кристаллической структуры - кристаллы СаТiO3: атомы Ti и О, соединенные ковалентными связями, образуют ажурный каркас, в полостях к-рого расположены атомы Са. Известны кристаллические структуры, в к-рых сосуществуют структурные фрагменты разных типов. Так, кристаллы комплексного соед. N(CH3)4[MnCl3] построены из "островов" - ионов N(CH3)4 и цепей, образованных атомами Мn, связанными мостиковыми атомами Cl. Часто встречаются кристаллические структуры с неполной упорядоченностью, в к-рых отдельные атомы или структурные фрагменты статистически занимают неск. возможных положений (напр., статистич. наложение слоев в CdI2). В нек-рых кристаллических структурах при достаточно высокой т-ре отдельные группы атомов или даже целые молекулы находятся в состоянии почти свободного или заторможенного вращения. По характеру связи между атомами или структурными фрагментами различают ковалентные кристаллы, ионные кристаллы, металлические кристаллы и ван-дер-ваальсовы кристаллы. Последняя группа включает, в частности, молекулярные кристаллы. Это деление (как и деление хим. связи на типы) условно, однако типичные представители разных групп резко различаются по св-вам, напр. по энергии структуры (энергия, необходимая для разъединения твердого тела на отдельные атомы, ионы или молекулы, отнесенная к 1 молю кристаллич. в-ва).Так, для ковалентных кристаллов SiC энергия структуры 1180 кДж/моль, для ионных NaCl 752 кДж/моль, для металлич. Na 108 кДж/моль, для мол. кристаллов СН4 10 кДж/моль. Важные характеристики кристаллической структуры - координац. числа К и координац. многогранники (полиэдры) атомов, из к-рых она состоит. Так, в структурах алмаза и сфалерита ZnS (рис. 2) для всех атомов К = 4 (координац. полиэдр - тетраэдр), в структуре NaCl К=6 (октаэдр), в структуре СаF2KCa=8 (куб), КF=4 (тетраэдр).
Зависимость свойств веществ от кристаллической структуры делает изучение кристаллических структур важным в практич. отношении. Так, слоистые кристаллы графита, галогенидов Cd, MoS2 способны легко раскалываться по плоскостям, к-рые параллельны слоям; на этом св-ве основано использование этих в-в в качестве твердых смазок. Небольшое смещение атомов Ва и Ti из центров координац. полиэдров в кристаллах ВаТiO3 приводит к возникновению у этого в-ва сегнетоэлектрич. св-в. Яркий пример зависимости св-в от строения дают цеолиты, кристаллические структуры к-рых содержат более или менее обширные полости с окнами, образованными в результате сцепления через общие вершины кремнекислородных и алюмокислородных тетраэдров SiO4 и АlО4. В результате кристаллы цеолитов избирательно поглощают более или менее крупные молекулы, их кристаллическая структура способна играть роль "мол. сита". Так, шабазит Na[AlSi2O6].3H2O (в прир. минерале Na частично заменен на Са), в кристаллической структуре к-рого присутствуют окна из 6 и 8 сцепленных тетраэдров, поглощает молекулы н-октана, но не изооктана, что позволяет выделить из бензина изооктановую фракцию. Структура цеолитов во многом определяет также их каталитич. св-ва. Лит. см. при статьях Кристаллохимия, Кристаллы. П. М. Зоркий.
