Плотная упаковка
ПЛОТНАЯ УПАКОВКА атомов и молекул, способ модельного описания кристаллических структур. Рассматривают т. наз. шаровые (атомные) упаковки, к-рые характерны для структур многих сравнительно простых по составу неорг. B-B, и мол. упаковки, свойственные молекулярным кристаллам.
Шаровые упаковки подразделяются на плотнейшие шаровые упаковки (ПШУ) и плотные шаровые кладки (ПШК). ПШУ построены из плотнейших слоев, показанных на рис., а, ПШК - из тех же слоев или из плотных слоев, показанных на рис., б. В ПШУ реализуется плотнейшее наложение слоев, при к-ром каждый шар касается трех слоев соседнего слоя; в итоге каждый шар в ПШУ имеет координац. число 12. Число слоев, приходящихся на период ПШУ, перпендикулярный плоскости слоя, наз. слойностью упаковки. В кристаллах наиб. распространены двуслойная (рис., в)и трехслойная (рис., г)ПШУ. В ПШК шары располагаются менее компактно и имеют более низкие координац. числа: 8-в объемноцентрир. кубич. кладке (рис., д), 6-в простой кубич. кладке (рис., е).
Очень многие структуры металлов и интерметаллич. соед. построены по принципу ПШУ или ПШК. Так, в кристаллах Mg, Be, Ru, Os и др. реализуется двуслойная ПШУ, в кристаллах Cu, Ag, Au, Ni и др.-трехслойная ПШУ, в La-четырехслойная ПШУ, в a-Fe, Na, К, Ba, Nb, Та и др.-объемноцентрированная кубич. ПШК, в кристаллах а-Ро-простая кубич. ПШК. По закону ПШУ располагаются также атомы в структурах отвердевших благородных газов. В ин-терметаллиде Cu3Au атомы Cu и Au совместно образуют трехслойную ПШУ.
Многие бинарные и более сложные структуры описывают в терминах ПШУ и ПШК, при этом считают, что атомы одного сорта располагаются в центрах шаров, образующих упаковку, а атомы др. сорта располагаются в центрах пустот. При этом шары, образующие ПШУ и ПШК, обычно оказываются несколько раздвинутыми (с учетом атомных радиусов). Во всех ПШУ присутствуют пустоты двух типов - тетраэдрические (окруженные по тетраэдру четырьмя шарами) и октаэдрические (окруженные по октаэдру шестью шарами), причем на каждый шар упаковки приходится две тетраэдрические и одна октаэдрическая пустоты. Аналогично рассматривают пустоты в ПШК (напр., в простой кубич. ПШК присутствуют кубич. пустоты-на каждый шар одна пустота). Примеры бинарных структур, описываемых в терминах ПШУ и ПШК: NaCl - трехслойная ПШУ (рис., ж), образуемая атомами Cl, где атомы Na занимают все октаэдрич. пустоты; CdCl2-аналогичная ПШУ, где атомы Cd занимают половину октаэдрич. пустот послойно; CaF2-простая кубич. кладка из атомов F, где атомы Ca занимают половину кубич. пустот в шахматном порядке.
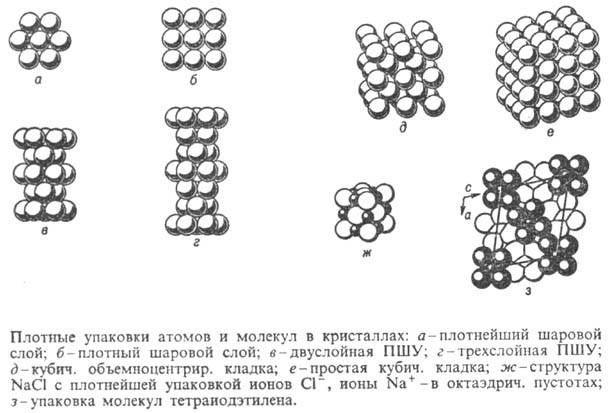
Согласно принципу плотной упаковки молекул, сформулированному А. И. Китайгородским, молекулы, моделируемые внеш. контуром пересекающихся ван-дер-ваальсовых сфер атомов, в кристаллах "касаются", т.е. не проникают друг в друга и не висят в пустоте. Расстояния между контактирующими атомами соседних молекул обычно отличаются от суммы ван-дер-ваальсовых радиусов не более чем на 5%. При этом молекулы (рис., з)располагаются достаточно плотно (выступ к впадине). Коэф. плотности упаковки k = zVмол/Vяч, где z -число молекул в ячейке, VMOJI-объем молекулы, Vяч-объем ячейки, близок к 0,7.
Лит. см. при ст. Кристаллы. П. M. Зоркий.
