Вторичная структура белка
Рентгеноструктурная кристаллография решает две главные проблемы белковой химии: закономерности чередования последовательности аминокислотных остатков в полипептидной цепи и закономерности конфигурации белковой молекулы.
Первые рентгенограммы белков, полученные еще в 30-х годах У. Астбю-ри, а затем Л. Полингом и Р. Кори, позволили установить наличие в белках наряду с линейной полипептидной цепью участков, определенным образом скрученных.
Под вторичной структурой белка подразумевают конфигурацию полипептидной цепи, т. е. способ свертывания, скручивания (складывание, упаковка) полипептидной цепи в спиральную или какую-либо другую конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре. Подробно изучены две основные конфигурации полипептидных цепей, отвечающих структурным требованиям и экспериментальным данным: α-спирали и β-структуры.
Благодаря исследованиям Л. Полинга наиболее вероятным типом строения глобулярных белков принято считать α-спираль (рис. 1.17). Закручивание полипептидной цепи происходит по часовой стрелке (правый ход спирали), что обусловлено L-аминокислотным составом природных белков. Движущей силой в возникновении α-спиралей (так же как и β-структур) является способность аминокислот к образованию водородных связей. В структуре α-спиралей открыт ряд закономерностей. На каждый виток (шаг) спирали приходится 3,6 аминокислотных остатка. Шаг спирали (расстояние вдоль оси) равен 0,54 нм на виток, а на один аминокислотный остаток приходится 0,15 нм. Угол подъема спирали 26°, через 5 витков спирали (18 аминокислотных остатков) структурная конфигурация полипептидной цепи повторяется. Это означает, что период повторяемости (или идентичности) α-спиральной структуры составляет 2,7 нм.
Для каждого белка характерна определенная степень спирализации его полипептидной цепи. Степень спирализации устанавливают путем измерения удельного вращения плоскости поляризованного света. Изменение последнего находится в прямой зависимости от степени спирализации белковой молекулы. Не все глобулярные белки спирализованы на всем протяжении полипептидной цепи. В молекуле белка α-спиральные участки чередуются с линейными. В частности, если α- и β-цепи гемоглобина спирализованы, например, на 75%, то лизоцима – на 42%, а пепсина – всего на 30%.
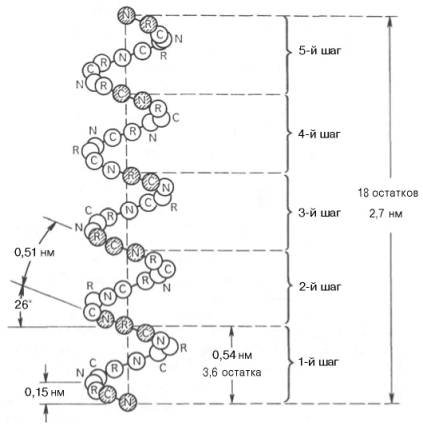
Рис. 1.17. Структура и параметры α-спирали.
Таким образом, стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят и главно-валентные связи – пептидные и дисульфидные).
Водородная связь представляет собой слабое электростатическое притяжение (взаимодействие, связь) между одним электроотрицательным атомом (например, кислородом или азотом) и водородным атомом, кова-лентно связанным со вторым электроотрицательным атомом. Типы водородных связей представлены далее.
По современным представлениям, водородная связь включает не только электростатические силы притяжения между полярными группами (взаимодействие атомов водорода с электроотрицательными элементами: кислородом, азотом, хлором), но и электронные связи такого же типа, как в ряде комплексных соединений. Водородные связи, являясь нековалентными, отличаются малой прочностью. Так, если для разрыва химических межатомных связей необходимо затратить от 84 до 8400 кДж, то для разрыва одной водородной связи требуется затратить всего лишь 6,3 кДж на 1 моль. Поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
Механизм возникновения водородных связей в элементарной форме может быть представлен на примере взаимодействия двух молекул воды (диполи). В диполе воды, как известно, избыток положительных зарядов приходится на атомы водорода, а избыток отрицательных – на атомы кислорода.
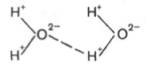
Благодаря особенностям строения атома водорода при достаточном сближении двух молекул воды возникает электростатическое взаимодействие между атомом кислорода одной молекулы и атомом водорода второй молекулы воды. Следствием этого является ослабление связи между атомами водорода и кислорода в каждой молекуле воды и соответственно возникновение новой, непрочной связи (отмечена пунктиром) между атомом водорода первой молекулы и атомом кислорода второй молекулы воды. Эту непрочную связь принято обозначать водородной связью.
В белковой молекуле наиболее важные водородные связи образуются между ковалентно связанным атомом водорода, несущим частичный положительный заряд, и отрицательно заряженным ковалентно связанным атомом кислорода. Ниже представлены примеры водородных связей в белковой молекуле: а) между пептидными цепями; б) между двумя гидрок-сильными группами; в) между ионизированной СООН-группой и ОН-груп-пой тирозина; г) между ОН-группой серина и пептидной связью.
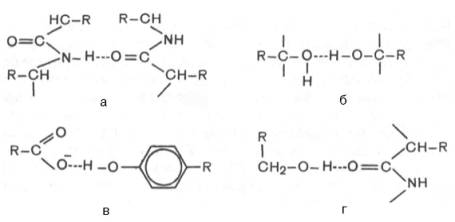
В зависимости от химической природы атома-акцептора водородные связи отличаются друг от друга степенью прочности. О количестве водородных связей в белковой молекуле судят по данным изотопного метода, в частности по времени обмена атомов водорода, участвующих в образовании водородной связи, на дейтерий (при обработке белка тяжелой водой D2O, в которой вместо обычного водорода содержится его тяжелый изотоп дейтерий).
Другой тип конфигурации полипептидных цепей, обнаруженный в белках волос, шелка, мышц и в других фибриллярных белках, получил название β-структуры. В этом случае две или более линейные полипептидные цепи, расположенные параллельно или, чаще, антипараллельно, прочно связываются межцепочечными водородными связями между NH-и СО-группами соседних цепей, образуя структуру типа складчатого слоя (рис. 1.18).
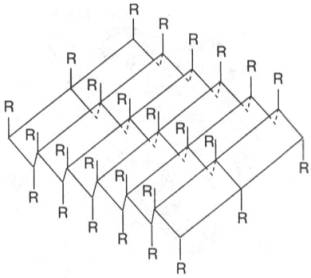
Рис. 1.18. β-Структура полипептидных цепей.
В природе существуют белки, строение которых, однако, не соответствует ни β-, ни α-структуре. Типичным примером таких белков является коллаген – фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных (см. главу 21).
Методами рентгеноструктурного анализа в настоящее время доказано существование еще двух уровней структурной организации белковой молекулы, оказавшихся промежуточными между вторичной и третичной структурами. Это так называемые надвторичные структуры и структурные домены.
Надвторичные структуры представляют собой агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся в некоторых белках в результате их термодинамической или кинетической стабильности. Так, в глобулярных белках открыты (βхβ)-элементы (представлены двумя параллельными β-цепями, связанными сегментом х), βαβαβ-элементы (представлены двумя сегментами α-спирали, вставленными между тремя параллельными β-цепями) и др. В больших глобулярных белках иногда содержатся неодинаковые структурные домены, выполняющие разные функции, как и однотипные домены в пределах одного мономерного белка, образующиеся, вероятнее всего, как результат влияния генов в первом случае или дупликации генов – во втором. Домены создаются объединением и чередованием α-спиралей и β-слоев, между которыми открываются более рыхлые структуры (рис. 1.19).
Домен – это компактная глобулярная структурная единица внутри полипептидной цепи. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы. Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.


