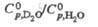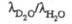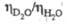Тяжёлая вода
ТЯЖЁЛАЯ ВОДА, оксид дейтерия D2O с кислородом прир. изотопного состава; мол. м. 20,02760; бесцв. жидкость без запаха и вкуса. Оксид водорода прир. изотопного состава с тяжелым изотопом 18O наз. тяжелокислородной водой, мол.м. 20,0157. Оксид протодейтерия HDO имеет мол. м. 19,02140. В смесях D2O с H2O с большой скоростью протекает изотопный обмен H2O + D2O 2HDO с константой равновесия К, близкой к 4,0 при 300-400 К. Поэтому дейтерий при малом содержании присутствует в воде почти целиком в форме HDO, а при высоком - в форме D2O. Для газа D2O
2HDO с константой равновесия К, близкой к 4,0 при 300-400 К. Поэтому дейтерий при малом содержании присутствует в воде почти целиком в форме HDO, а при высоком - в форме D2O. Для газа D2O 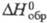 -249,200 кДж/моль, HDO -245,270 кДж/моль; отношение значений
-249,200 кДж/моль, HDO -245,270 кДж/моль; отношение значений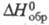 D2Oж и Н2ОЖ 1,027 (ж - жидкость); для D2жx С°р 84,31 Дж/(моль·К),
D2Oж и Н2ОЖ 1,027 (ж - жидкость); для D2жx С°р 84,31 Дж/(моль·К), 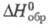 -294,60 кДж/моль,
-294,60 кДж/моль, 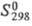 75,90 Дж/(моль·К); энергия разрыва связей (кДж/моль) при 298,15 К для D2O
75,90 Дж/(моль·К); энергия разрыва связей (кДж/моль) при 298,15 К для D2O ODо + Dо 508,276; HDO
ODо + Dо 508,276; HDO ОНо +Dо 506,184 и HDO
ОНо +Dо 506,184 и HDO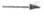 ODо + Hо 500,323 (для H2O 498,7 кДж/моль). Строение молекул D2O такое же, как молекул H2O, с очень малым различием в значениях длин связей и углов между ними. Для конденсир. состояния характерна водородная связь.
ODо + Hо 500,323 (для H2O 498,7 кДж/моль). Строение молекул D2O такое же, как молекул H2O, с очень малым различием в значениях длин связей и углов между ними. Для конденсир. состояния характерна водородная связь.
В поверхностных водах отношение D/(H+D)=(1,32-1,51)-10-4, в прибрежной морской воде D/(H + D) = = (1,55 - 1,5 6)·10 , по международному стандарту воды SMOW (Standard Marine Ordinary Water) D/H= 1,5576·10-4. Для прир. вод СНГ чаще всего характерны отрицат. отклонения от SMOW на (1,0 — 1,5) · 10-5, в отдельных случаях до (6,0-6,7)·10-5, встречаются положит, отклонения до 2,0·10-5. В условном пересчете на D2O (в прир. воде дейтерий содержится в форме HDO) прир. содержание тяжёлой воды в воде принимают равным 0,0145 - 0,0146 мол. %.
Свойства. Для тяжёлой воды т. кип. 101,44 0C, т.пл. 3,823 0C; tкрит 643,89 К, pкрит 21,66 МПа, критич. молярный объем 56,1 см3; DH0исп 45,391 кДж/моль, DH0пл 6,01 кДж/моль; плотн. при 20 0C 1,10539 г/см3, приведенная к воде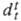 1,10735, макс. плотн. 1,10602 г/см3 при 11,24 0C; скорость звука в тяжёлой воде 1386 м/с (20 0C);
1,10735, макс. плотн. 1,10602 г/см3 при 11,24 0C; скорость звука в тяжёлой воде 1386 м/с (20 0C); 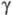 67,8 мН/м (20 0C), для смесей
67,8 мН/м (20 0C), для смесей 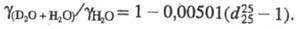 Отношение значений уд.
Отношение значений уд. 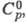 теплопроводности
теплопроводности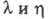 D2O и H2O:
D2O и H2O:
| Т, К | | | | ||
| 293,15 | 1,006 | 1,025 | 1,333 | ||
| 333,15 | 1,002 | 1,050 | 1,123 | ||
| 373,15 | 0,992 | 1,072 | 1,117 | ||
Для тяжелого льда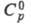 при 270 К 44,128 Дж/(моль·К). Отношение значений
при 270 К 44,128 Дж/(моль·К). Отношение значений 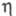 паров D2O и H2O в интервале 353-403 К в среднем равно 1,06. Коэф. самодиффузии при 318,15 K DD2о 2,979·10-9 м2/с. Коэф. диффузии изотопных форм воды:
паров D2O и H2O в интервале 353-403 К в среднем равно 1,06. Коэф. самодиффузии при 318,15 K DD2о 2,979·10-9 м2/с. Коэф. диффузии изотопных форм воды:
| Т, К | DHD0 в H2O, м2/с | DHD0 в D2O, м2/с | ||
| 298,15 | 2,272·10-9 | 1,902·10-9 | ||
| 318,15 | 3,532·10-9 | 3,027·10-9 | ||
Кристаллы D2O имеют такую же структуру, как и кристаллы обычного льда, различие в размерах элементарной ячейки очень мало (0,1%). Изменение объема при плавлении тяжелого льда 1,57 см3/моль (0,97 значения изменения объема для H2O). Молярный объем твердой D2O при 273,15 К ~ 19,670 см3. См. также табл. 1, 2.
T а б л. 1. - СВОЙСТВА ТЯЖЕЛОЙ ВОДЫ И ЕЕ НАСЫЩЕННОГО ПАРА
| T, К | кПа | Уд. объем, см3/г | DHисп, кДж/кг | |||
| жидкость | пар | |||||
| 293,15 | 2,01 | 0,0009047 | 60,45 | 2281,4 | ||
| 313,15 | 6,59 | 0,0009091 | 19,66 | 2230,7 | ||
| 333,15 | 18,3 | 0,0009170 | 7,517 | 2180,7 | ||
| 353,15 | 46,4 | 0,0009274 | 3,273 | 2128,2 | ||
| 373,15 | 96,4 | 0,0009403 | 1,582 | 2074,1 | ||
| 393,15 | 191,1 | 0,0009556 | 0,8326 | 2017,6 | ||
Табл. 2.- ПОЛОЖЕНИЕ ОСНОВНЫХ ПОЛОС ПОГЛОЩЕНИЯ В ИK СПЕКТРЕ, см-1
| Характер колебания | HDO | D2O | ||||
| пар | жидкость | пар | жидкость | |||
| Симметричные валентные | 2724 | 2500 | 2672 | 2389 | ||
| Антисимметричные валентные | 3708 | 3400 | 2788 | 2550 | ||
| Деформационные | — | — | 1179 | 1208 | ||
Тяжёлая вода менее летуча, чем H2O. Отношение значений давления паров H2O и D2O в интервале 277-387 К: ln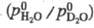 = -70,87/T+ 33630/Т2.
= -70,87/T+ 33630/Т2.
Это отношение с ростом т-ры уменьшается до 1 при 498 К, при т-рах выше 498 К D2O становится более летучей, чем H2O.
Давление пара HDO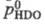 =
=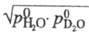 . При постоянной т-ре козф. разделения жидкость - пар для смеси H2O + D2O
. При постоянной т-ре козф. разделения жидкость - пар для смеси H2O + D2O 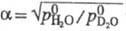 и не зависит от соотношения D/H;
и не зависит от соотношения D/H; 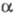 = 1,026 (373 К), 1,053 (323 К). Смеси H2O + D2O практически ведут себя как идеальные р-ры.
= 1,026 (373 К), 1,053 (323 К). Смеси H2O + D2O практически ведут себя как идеальные р-ры.
Отношение значений давления паров D2O и H2O над твердой фазой в интервале 243-273 К Ig 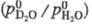 = 0,0376 — 35,65/Г. Давление пара тяжёлой воды над кристаллогидратами солей на 10-20% ниже по сравнению с H2O. Показатель преломления тяжёлой воды
= 0,0376 — 35,65/Г. Давление пара тяжёлой воды над кристаллогидратами солей на 10-20% ниже по сравнению с H2O. Показатель преломления тяжёлой воды 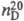 1,328300, молярная рефракция R 3,679, поляризуемость 1,45962·0-24 см3 при 293,15 К и длине волны 589,3 HM.
1,328300, молярная рефракция R 3,679, поляризуемость 1,45962·0-24 см3 при 293,15 К и длине волны 589,3 HM.
Р-римость, а также растворяющая способность D2O, как правило, ниже, чем у H2O, хотя известны и обратные эффекты. Так, р-римость в D2O ниже, чем в H2O, у сулемы при 0 0C на 42%, K2Cr2O7 при 5 0C на 33,5%, K2SO4 при 25 0C на 20,5%. Р-римость D2O в орг. жидкостях по сравнению с H2O снижается при 25 0C в триэтиламине на 30%, CS2 на 21,0%, бензоле на 17%, CHCl3 на 15%, хлорбензоле на 12%. Наблюдается также изменение критич. т-ры растворения, напр.: в системе C3H7COOD - D2O на 22,4 К, C6H5OD - D2O на 19,9 К.
Тяжёлая вода слабее ионизирована, чем H2O. Константа ионизации D2O при 298,15 К lg K=-14,71. Значения e (78,06 при 298,15 К), дипольного момента (6,24·10-30 Кл·м) и диамагнитной восприимчивости (при 293,15 К -1,295·10-5) D2O почти не отличаются от тех же величин для H2O. Подвижность ионов D3O+ в одной и той же среде на 28,5% ниже, чем у H3O+, a OD- - на 39,8% ниже, чем у ОН-. Для мн. др. ионов различие подвижностей в среде H2O и D2O составляет ок. 18%. Константа диссоциации слабых к-т и оснований снижается в D2O по сравнению с H2O, напр.: для уксусной к-ты 0,51·10-5 в D2O и 1,7·10-5 в H2O, для бензойной к-ты соотв. 1,95·10-5 и 6,09·10-5.
Большая прочность связи D — О, чем H — О, обусловливает различия в кинетике р-ций тяжёлой воды и воды. Протолитич. р-ции и биохим. процессы в D2O значительно замедлены. Однако существуют и такие р-ции, скорость к-рых в тяжёлой воде выше, чем в H2O. В осн. это р-ции, катализируемые ионами D+ и H+ или OD- и OH-.
Получение. Тяжёлая вода для ядерной техники должна иметь концентрацию не менее 99,81 молярных % D2O. Совр. мировое произ-во составляет неск. тысяч т в год. Осн. страны-производители - Канада, США, Индия, Норвегия. Получают тяжёлую воду выделением из воды или водорода с естеств. изотопным составом. Ввиду малости коэф. разделения и низкого содержания в сырье произ-во тяжёлой воды разделяют на 2 стадии - начальное концентрирование (от прир. концентрации до 5-10% в пересчете на D2O) и конечное концентрирование (от 5-10% до 99,8% D2O). Осн. пром. способы на первой стадии: изотопный обмен между водой и H2S в двух-, трехступенчатой каскадной системе противоточных колонн по двухтемпера-турной схеме (см. Изотопов разделение); многоступенчатый электролиз воды в сочетании с каталитич. изотопным обменом между водой и H2; низкотемпературная ректификация жидкого H2 с послед, сжиганием D2 с O2; изотопный обмен между H2 и NH3 в присут. KNH2 и др. Для конечного концентрирования тяжёлой воды в осн. используют ректификацию воды под вакуумом или электролиз.
Для определения концентрации D2O в воде используют денсиметрию (пикнометрич., поплавковый и капельный методы), катарометрию (по изменению теплопроводности), рефрактометрию, ИК спектроскопию, масс-спектрометрию и др. методы.
Применение. Тяжёлая вода - лучший замедлитель нейтронов; коэф. замедления нейтронов 5700, поперечное сечение захвата тепловых нейтронов 0,46·10-30 м2 (для воды соответствующие величины 61 и 0,33·10-28 м2). Поэтому тяжёлую воду применяют гл. обр. в качестве замедлителя нейтронов и теплоносителя в энергетич. и исследовательских ядерных реакторах на тепловых нейтронах (тяжеловодные реакторы). Перспективно использование тяжёлой воды как источника D2 для термоядерного синтеза. Тяжёлая вода - источник дейтронов в ускорителях частиц, изотопный индикатор, р-ритель в спектроскопии ЯМР.
Тяжёлая вода - яд, т. к. замедляет биол. процессы, действует угнетающе на живые организмы.
Тяжёлая вода открыта в 1932 Г. Юри, Ф. Брикведде и Дж. Мёрфи, впервые получена в чистом виде и изучена в 1933 Г. Льюисом и P. Макдональдом.
Лит.: Киrшенбаум И., Тяжелая вода. Физические свойства и методы анализа, пер. с англ., M., 1953; Шатенштейн А.И., Изотопный анализ воды, 2 изд., М., 1957; Казавчинский Я. 3. [и др.], Тяжелая вода, тепло-физические свойства, M.-Л., 1963; Андреев Б.M., Зельвенский Я.Д., Катальников С. Г., Тяжелые изотопы водорода в ядерной технике, M., 1987. Я. Д. Зельвенский.