Изотопный обмен
ИЗОТОПНЫЙ ОБМЕН, самопроизвольное перераспределение изотопов хим. элемента между разл. фазами системы (в частности, между разл. агрегатными состояниями одного и того же в-ва), частицами (молекулами, ионами) или внутри молекул (сложных ионов). В изотопном обмене могут участвовать как стабильные, так и радиоактивные нуклиды. При изотопном обмене сохраняется неизменным элементный состав каждого участвующего в обмене в-ва, изменяется лишь его изотопный состав. Если обменивающиеся изотопами молекулы, ионы и т. п. находятся в одной фазе, изотопный обмен наз. гомогенным, если в разных фазах - гетерогенным. Так, при гомогенном изотопном обмене с участием молекул воды 1Н1НО и DDO образуются молекулы HDO; при гетерог. изотопном обмене между парами иода, меченного радионуклидом 131I, и кристаллич. иодом радиоактивные атомы переходят из пара в кристаллы. В результате изотопного обмена изотопный состав всех форм выравнивается и устанавливается равномерное распределение изотопов (равнораспределение). Изотопный обмен можно рассматривать как обычную хим. р-цию, в к-рой исходные в-ва и продукты различаются изотопным составом. Внутр. энергия системы при этом практически не изменяется (нулевые частоты колебаний молекул, обменивающихся изотопами, почти одинаковы) и тепловой эффект Q = 0. Последнее означает, что для прямого и обратного изотопного обмена энергии активации равны; кроме того, константы равновесия К практически не зависят от т-ры. Если в изотопном обмене участвуют легкие элементы, становятся заметными изотопные эффекты, вследствие чего константы равновесия могут существенно отличаться от 1. Чем ближе система, в к-рой протекает изотопный обмен, к состоянию равнораспределения, тем больше число вариантов распределения изотопов в системе, т. е. выше число микросостояний, через к-рое м. б. реализована система. Т. обр., при изотопном обмене энтропия системы растет; максимум энтропии достигается при равнораспределении. Скорость изотопного обмена во многом зависит от его механизма. В частности, гомог. изотопный обмен может протекать по диссоциативному или ассрциативному механизму, м. б. связан с переносом электрона или с перемещением групп атомов. Напр., обмен радиоактивным иодом между кристаллами AgI и р-ром, содержащим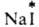 (здесь и далее знак * указывает радиоактивный атом), протекает в результате диссоциации
(здесь и далее знак * указывает радиоактивный атом), протекает в результате диссоциации 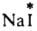 и AgI в р-ре. Обмен хлором между газообразным
и AgI в р-ре. Обмен хлором между газообразным 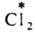 и парами FeCl3 также определяется диссоциацией FeCl3 при нагр. с образованием FeCl2 и атома Сl:
и парами FeCl3 также определяется диссоциацией FeCl3 при нагр. с образованием FeCl2 и атома Сl: 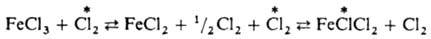
По ассоциативному механизму происходит изотопный обмен иодом между алкилиодидом и иодидом натрия в спиртовом р-ре:
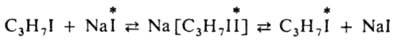
Изотопный обмен, протекающий по механизму переноса электрона, - это обычная окислит.-восстановит. р-ция. Таков, напр., обмен между разл. изотопами Тl , входящими в состав TlNO3 и
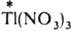 :
: 
Механизм, связанный с перемещением групп атомов, часто наблюдается при гетерог. изотопном обмене; так протекает, напр., изотопный обмен углеродом между газообразным
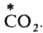 и твердым ВаСО3:
и твердым ВаСО3: 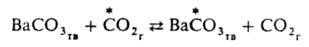
-ln(1 - F) = (ln2/t1/2)t,
к-рое позволяет по эксперим. значениям F определить t1/2 и рассчитать константу скорости изотопного обмена. Напр., для бимолекулярного изотопного обмена (р-ция второго порядка) константа скорости k равна:
k = (ln 2/t1/2)[1/(a + b)],
где а и b - молярные концентрации обменивающихся форм. Определив значения k при разных т-рах, можно на основании ур-ния Аррениуса найти энергию активации изотопного обмена, что позволяет, в частности, судить о прочности связи атомов, участвующих в изотопном обмене. Скорость гетерог. изотопного обмена зависит как от скорости подвода и отвода обменивающихся атомов от пов-сти раздела фаз, так и непосредственно от скорости самого изотопного обмена. Если в изотопном обмене участвует твердая фаза, то при достаточно интенсивном перемешивании паровой или жидкой фаз скорость всего процесса определяется скоростью диффузии обменивающегося атома от границы раздела фаз вовнутрь твердой фазы. Изотопный обмен используют при изотопов разделении, получении меченых соединений; с его помощью изучают строение молекул. На анализе изотопного обмена основан один из способов определения низких давлений насыщенных паров. В отд. случаях изотопный обмен может исказить результаты опыта; так, при изучении изотопного обмена между в-вами, растворенными в воде, нужно учитывать возможность обмена изотопов водорода между исследуемыми в-вами и молекулами воды. Литература
