Гидроний
Гидроний, ион гидрония, ион гидроксония, гидратированный ион водорода в водном растворе H3O+. Свободный водородный ион Н+ (т. е. ядро атома водорода — протон) в растворе связывается с молекулами воды, образуя главным образом ион гидрония: H+ + H2O = H3O+. Из-за незначительного размера протона (10-13 см; радиусы остальных ионов имеют величину порядка 10-8 см) он создаёт сильное электрическое поле; между ним и неподелённой парой электронов кислорода молекулы воды возникает ковалентная связь. Образование иона гидрония аналогично образованию иона аммония NH4+ (см. Азот); установлено, что кристаллогидрат хлорной кислоты HClO4·H2O имеет ионную кристаллическую решётку, изоморфную перхлорату аммония 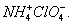 Ион H3O+ в кристаллах носит название оксония (в отличие от гидрония — иона H3O+ в растворе). Вследствие ассоциации молекул воды ион гидрония оказывается связанным с большим количеством воды. Получающиеся при этом гидратированные ионы гидрония выражают формулами H5O2+, H7O3+, H9O4+.
Ион H3O+ в кристаллах носит название оксония (в отличие от гидрония — иона H3O+ в растворе). Вследствие ассоциации молекул воды ион гидрония оказывается связанным с большим количеством воды. Получающиеся при этом гидратированные ионы гидрония выражают формулами H5O2+, H7O3+, H9O4+.
Лит.: Самойлов О. Я., Структура водных растворов электролитов и гидратация ионов, М., 1957; Неницеску К., Общая химия, пер. с рум., М., 1968.

Дополнения к описанию гидрония: