Гидразин
ГИДРАЗИН N2H4 (диамид), бесцв. дымящая на воздухе жидкость с неприятным запахом. Длина связи N—N 0,1449 нм, N—H 0,1021 нм; угол HNH 106°, NNH-1120, угол между плоскостями групп NH, 91° (гош-конформация);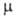 6,04*10-30 Кл*м. Т. кип 113,5°С; давление пара 18,6 гПа (25°С); С° 98,83 Дж/(моль*К);
6,04*10-30 Кл*м. Т. кип 113,5°С; давление пара 18,6 гПа (25°С); С° 98,83 Дж/(моль*К);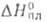 12,66 кДж/моль,
12,66 кДж/моль,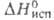 44,77 кДж/моль; So298 121,3 Дж/(моль*К);
44,77 кДж/моль; So298 121,3 Дж/(моль*К);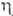 0,90мПа*с;
0,90мПа*с;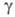 66,7 мН/м;
66,7 мН/м;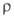 0,625*105 Ом*м;
0,625*105 Ом*м;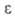 51,7; nD22 1,4695 (см. также табл.).
51,7; nD22 1,4695 (см. также табл.).
Гидразин смешивается в любых соотношениях с водой, жидким NH3, спиртом; в неполярных р-рителях раств. плохо. С водой образует моногидрат, или гидразингидрат (т. пл. -51,6°С, т. кип. 118,5°С), тетрагидрат (т. пл. -80°С, т-ра эвтектики моногидрат-тетрагидрат -87°С), а также азеотроп (58,5 мол. % гидразина; т. кип. 120,5°С). Жидкий гидразин ассоциирован и слабо ионизован (2N2H4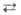 N2H5++N2H3-; К
N2H5++N2H3-; К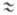 10-13). В нем хорошо раств. ми. соли, напр. LiCl, СаС12, NaNO3, NaClO4, Mg(ClO4)2. Большинство солей кристаллизуется из безводного гидразина и гидразингидрата в виде прочных сольватов, напр. [Li(N2H4)2]ClO4, [Mg(N2H4)2](NO3)2. В таких комплексах молекулы гидразина служат мостиковыми бидентатными или монодентатными лигандами. Энергия связи ионов непереходных металлов с гидразином выше, чем с NH3 и водой.
10-13). В нем хорошо раств. ми. соли, напр. LiCl, СаС12, NaNO3, NaClO4, Mg(ClO4)2. Большинство солей кристаллизуется из безводного гидразина и гидразингидрата в виде прочных сольватов, напр. [Li(N2H4)2]ClO4, [Mg(N2H4)2](NO3)2. В таких комплексах молекулы гидразина служат мостиковыми бидентатными или монодентатными лигандами. Энергия связи ионов непереходных металлов с гидразином выше, чем с NH3 и водой.
Гидразин термически малостабилен. Распад его в жидком и газообразном состояниях происходит с выделением тепла по ур-ниям:
При 200-300 °С в отсутствие катализаторов преобладает направление (1). Металлы ускоряют разложение паров гидразина, при этом их каталитич. активность изменяется в ряду Ir > Rh >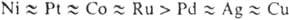 . Родий, Pt и Pd направляют процесс по р-ции (2). В присут. остальных металлов ее вклад менее 10%.
. Родий, Pt и Pd направляют процесс по р-ции (2). В присут. остальных металлов ее вклад менее 10%.
Гидразин-сильный восстановитель. Интенсивно окисляется О2 воздуха до N2, NH3, H2O; пар гидразина горит синим пламенем. В щелочной среде окисляется медленно, ионы переходных металлов, особенно Сu2 +, ускоряют эту р-цию. Окисляется солями Се4+, Fe3+, Мn3+ , Со3+ до NH3, N2 и воды, I2, Вr2, С12, ВrO3-, IO3-, IO4-, МnО4- до N2 и воды, Н2О2, HNO2, S2O82-, Mo(VI) до NH3, иногда до N2O. Нек-рые соли переходных металлов восстанавливаются гидразин до металлов.
В водном р-ре гидразин-слабое основание, образующее одно-и двухзарядные ионы гидразония: 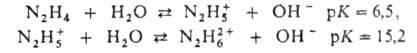
Известно большое число солей, отвечающих обеим ионным формам гидразония, св-ва Наиб. важных из них приведены в таблице.
СВОЙСТВА ГИДРАЗИНА И СОЛЕЙ ГИДРАЗОНИЯ 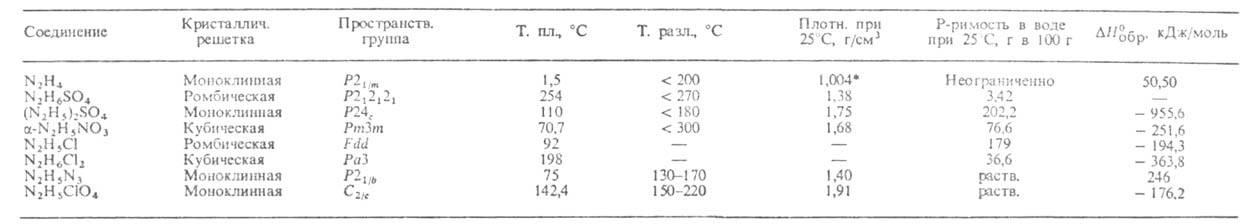
* Плотн. твердого 1,146 г/см3.
При алкилировании или арилировании гидразина образуются алкил- и арилгидразины, при р-ции с карбонильными соед.— гидразоны и азины (см. Гидразина замещенные органические). Примеры неорг. производных гидразина, образующихся при замещении атомов Н,-гидразинсерная к-та N2H3SO3H, тетрафторгидразин N2F4. При действии амидов, гидридов или своб. металлов на безводный гидразин образуются весьма взрывоопасные гидразиды, напр. NaHNNH2, используемые как реагенты в орг. синтезе. Будучи донором электронных пар, гидразин может образовывать молекулярные комплексы с к-тами Льюиса (L) типа N2H4*L и N2H4*2L. Наиб. важные из них - кристаллич. гидразинборан N2H4*BH3 (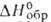 —43 кДж/моль) и гидразинбисборан N2H4*2BH3 (
—43 кДж/моль) и гидразинбисборан N2H4*2BH3 (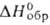 - 127 кДж/моль). Оба соед., по зарубежным данным,-энергоемкое ракетное горючее. Гидразин получают окислением NH3 или CO(NH2)2 гипохлоритом Na:
- 127 кДж/моль). Оба соед., по зарубежным данным,-энергоемкое ракетное горючее. Гидразин получают окислением NH3 или CO(NH2)2 гипохлоритом Na:
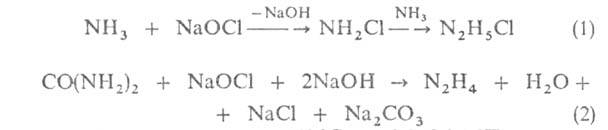
Р-цию (1) проводят при 160°С и 2,5-3,0 МПа, р-цию (2)-при т-ре выше 100oС и нормальном давлении для предупреждения побочной р-ции: 2NH2C1 + N2H4 -> N2 + 2NH4C1 в смесь добавляют, напр., глицерин или желатину. Полученную смесь растворяют в 50%-ной H2SO4 и получают 2-3%-ные р-ры сульфата гидразина, к-рые затем обрабатывают NH3 и концентрируют (до содержания гидразина 60%) дистилляцией при нормальном давлении или в вакууме; 70-90%-ный гидразин получают, напр., экстрактивной дистилляцией с анилином, 1,2,6-гексатринитрилом, безводный гидразин-обработкой гидразингидрата твердым NaOH с послед. перегонкой над NaOH, вымораживанием конц. водного р-ра гидразина, пиролизом цианурата N2H4*3HCNO при 147°С. Гидразин можно также получить р-цией элементного хлора с NH3 при — 30°С, илазмохимическим или радиохимическим разложением NH3.
Обнаруживают гидразин по образованию окрашенных соед. с нек-рыми альдегидами, напр. с диметиламинобензальдегидом. Гидразин, 1,1-диметилгидразин и их смеси-горючие компоненты в ракетных топливах. Гидразин используют также как горючее в топливных элементах, ингибитор коррозии паровых котлов, для получения чистых металлов (Си, Ni и др.) из их оксидов и солей. Гидразин, его соли и гидраты применяют: в произ-ве порообразователей (напр., бензолсульфонилгидразида), инсектицидов, ВВ, регуляторов роста растений (напр., гидразида маленновой к-ты), лек. ср-в (напр., противотуберкулезного ср-ва - гидразида изоникотиновой к-ты); как реактивы (в частности, для обнаружения карбонильных групп, пшохлоритов и хлоратов); для получения промежут. продуктов и красителей; в кач-ве добавок в стекломассу (напр., для устранения тусклости стекол); как реагенты для очистки пром. газов от СО2 и меркаптанов.
Гидразин и его водные р-ры сильно ядовиты, раздражают слизистые оболочки, глаза и дыхат. пути, поражают центр. нервную систему и печень. При попадании гидразина на кожу требуется немедленная ее обработка водой или слабым р-ром к-т; ПДК 0,1 мг/г3, пороговая концентрация, приводящая к миним. нарушениям высшей нервной деятельности, 0,02 мг/л, концентрация 0,0039 мг/л переносится 60 мин, 0,013 мг/л-10 мин, смертельная концентрация 1-2 мг/л. Пром. сточные воды, содержащие гидразин, обрабатывают С12 или хлорной известью либо пропускают через адсорберы с активным углем, стекловатой, золой, шлаком. Гидразин образует взрывоопасные смеси с воздухом и О2, способен к воспламенению в присут. асбеста, угля, оксидов Сu, Fe, Hg и др.; в воздухе т. всп. 270 °С (в чистом О2 и в присут. металлов и их оксидов т-ра вспышки понижается); нижний КПВ 4,7%
Литература
Одрит Л., Огг Б., Химия гидразина, пер. с англ., М., 1954; Греков А.П., Веселое В. Я., Физическая химия гидразина, К., 1979; Коровин Н. В., Гидразин, М., 1980. В. Я. Росоловский. Н.С. Торочешников.
