Гемоглобин
ГЕМОГЛОБИН (от греч. haima- кровь и лат. globus-шар), осн. белок дыхат. цикла, участвующий в переносе О2 от органов дыхания к тканям, а в обратном направлении - СО2. Содержится в эритроцитах крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных. Гемоглобин позвоночных (мол. м. 6,4*104-6,6*104) состоят из четырех попарно идентичных субъединиц (их обозначают греч. буквами; теми же буквами обозначают входящие в состав субъединиц полипептидные цепи, а также гены, кодирующие эти цепи). Каждая субъединица имеет белковую глобиновую часть, состоящую из 140-160 аминокислотных остатков, с к-рой нековалентно связан гем-ферропрото-порфирин (см. ф-лу).
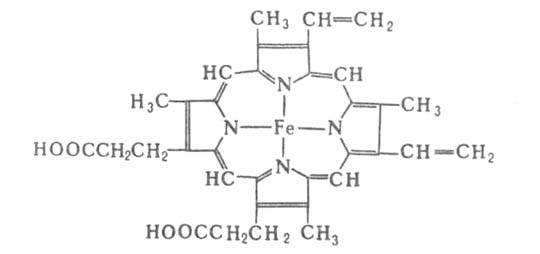
Ф-цию переноса О2 у нек-рых видов беспозвоночных выполняют крупные гемсодержащие белки-эритрокруорины (мол. м. 0,4*106-6,7*106), состоящие из 30-400 субъединиц, и хлоркруорины (мол. м. 3,4*106), состоящие из 190 субъединиц. Эти белки способны обратимо связывать одну молекулу О2 на группу гема, т.е. на субъединицу. Переносчиком О2 у др. видов беспозвоночных служат негемовые белки, состоящие из 8-10 субъединиц,— медьсодержащие гемоцианины (мол. м. 0,05*107*107) и железосодержащие гемэритрины (мол. м. 1*105). Каждая субъединица таких белков содержит два атома металла (соотв. Сu + и Fe2 +), способных связать одну молекулу О2.
Гемоглобин взрослого человека (НbА) имеет мол. м. 6,49*104 и принадлежит к числу наиб. изученных белков. Его форма в р-ре близка к эллипсоиду с осями 6,4, 5,5 и 5,0 нм; изоэлектрич. точка 6,9. Тетрамер НЬА состоит из двух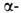 и двух
и двух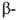 субъединиц, их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков. Известны первичная структура обеих цепей, а также пространств. структура оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной формы (содержит Fe3 +) НbА. Пространств. структура субъединиц (рис. 1) характеризуется наличием восьми
субъединиц, их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков. Известны первичная структура обеих цепей, а также пространств. структура оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной формы (содержит Fe3 +) НbА. Пространств. структура субъединиц (рис. 1) характеризуется наличием восьми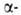 спиральных участков, включающих около 80% аминокислотных остатков, и внутр. полости -гемового кармана. Фиксирование гема в субъединице осуществляется в результате гидрофобных взаимод. пиррольных и винильных групп гема с алифатич. и ароматич. боковыми радикалами аминокислот, выстилающими полость кармана, а также благодаря координационной связи (направлена перпендикулярно к плоскости кольца гема) Fe2+ с аксиальным лигандом-имидазольной группой гистидина (т. наз. проксимальный гистидин). При оксигенации молекула О2 занимает шестое вакантное место в координационной сфере Fe2+. Связывание происходит обратимо, без окисления железа, с образованием стабильного оксигенированного комплекса НbО2. Одна молекула гемоглобина способна присоединить 4 молекулы О2-по одной на группу гема.
спиральных участков, включающих около 80% аминокислотных остатков, и внутр. полости -гемового кармана. Фиксирование гема в субъединице осуществляется в результате гидрофобных взаимод. пиррольных и винильных групп гема с алифатич. и ароматич. боковыми радикалами аминокислот, выстилающими полость кармана, а также благодаря координационной связи (направлена перпендикулярно к плоскости кольца гема) Fe2+ с аксиальным лигандом-имидазольной группой гистидина (т. наз. проксимальный гистидин). При оксигенации молекула О2 занимает шестое вакантное место в координационной сфере Fe2+. Связывание происходит обратимо, без окисления железа, с образованием стабильного оксигенированного комплекса НbО2. Одна молекула гемоглобина способна присоединить 4 молекулы О2-по одной на группу гема.
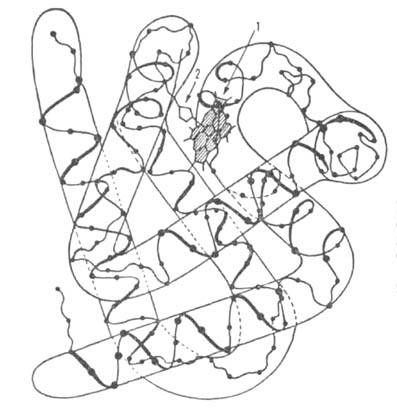
Рис. 1. Схема упаковки полипептидной цепи 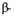 субъединицы гемоглобина. Точками обозначены положения
субъединицы гемоглобина. Точками обозначены положения 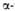 С атомов аминокислотных остатков; 1 -гем; 2-проксимальный остаток гистидина.
С атомов аминокислотных остатков; 1 -гем; 2-проксимальный остаток гистидина.
Субъединицы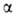 и
и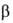 прочно удерживаются в составе тетрамера гемоглобина множественными ван-дер-ваальсовыми взаимод. и водородными связями; дезоксигенированная форма НbА стабилизирована кроме того неск. ионными связями внутри и между субъединицами. Тетрамер гемоглобина-кооперативная структура, в к-рой существует взаимод. пространственно разобщенных между собой групп (т. наз. гем-гем взаимодействие). Это проявляется в облегчении присоединения к тетрамеру последующих молекул О2 по мере протекания оксигенирования, что значительно увеличивает эффективность переноса О2 при физиол. условиях по сравнению с мономерными гемоглобином и миоглобином (белок, депонирующий О2 в мышцах). Присоединение О2 к молекуле гемоглобина сопровождается значит. конформационными перестройками пространств. структуры субъединиц и тетрамера в целом.
прочно удерживаются в составе тетрамера гемоглобина множественными ван-дер-ваальсовыми взаимод. и водородными связями; дезоксигенированная форма НbА стабилизирована кроме того неск. ионными связями внутри и между субъединицами. Тетрамер гемоглобина-кооперативная структура, в к-рой существует взаимод. пространственно разобщенных между собой групп (т. наз. гем-гем взаимодействие). Это проявляется в облегчении присоединения к тетрамеру последующих молекул О2 по мере протекания оксигенирования, что значительно увеличивает эффективность переноса О2 при физиол. условиях по сравнению с мономерными гемоглобином и миоглобином (белок, депонирующий О2 в мышцах). Присоединение О2 к молекуле гемоглобина сопровождается значит. конформационными перестройками пространств. структуры субъединиц и тетрамера в целом.
Сродство гемоглобина к О2 является основным физ.-хим. показателем функциональных св-в гемоглобина; его принято характеризовать зависимостью степени оксигенирования гемоглобина от парциального давления кислорода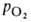 (кислородно-диссоционная кривая, или КДК, рис. 2), а также величиной
(кислородно-диссоционная кривая, или КДК, рис. 2), а также величиной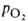 , при к-рой достигается оксигенирование 50% гемоглобина (р50)- Нормальная величина р50 НbА в крови при физиол. условиях [37 °С, парциальное давление СО2
, при к-рой достигается оксигенирование 50% гемоглобина (р50)- Нормальная величина р50 НbА в крови при физиол. условиях [37 °С, парциальное давление СО2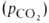 40 мм рт. ст., рН 7,4] составляет 26-28 мм рт. ст. Сигмоидный характер КДК отражает кооперативный характер оксигенирования. При существующем у человека различии артериальной и венозной крови (соотв. 90 ± 10 и 40 ±
40 мм рт. ст., рН 7,4] составляет 26-28 мм рт. ст. Сигмоидный характер КДК отражает кооперативный характер оксигенирования. При существующем у человека различии артериальной и венозной крови (соотв. 90 ± 10 и 40 ±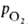 2 мм рт. ст.) 1 л крови, насыщенной в легких кислородом (92-98% гемоглобина находится в форме НbО2), отдает в тканях ок. 45 мл О2, при этом содержание НbО2 в венозной крови составляет 70-75%.
2 мм рт. ст.) 1 л крови, насыщенной в легких кислородом (92-98% гемоглобина находится в форме НbО2), отдает в тканях ок. 45 мл О2, при этом содержание НbО2 в венозной крови составляет 70-75%.
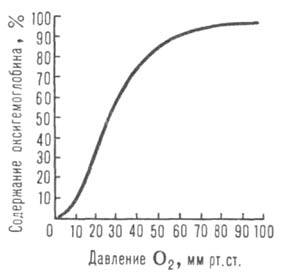
Рис. 2. Зависимость содержания оксигемоглобина от парциального давления кислорода.
Из клеток тканей СО2 диффундирует через плазму крови в эритроциты, где гидратируется в р-ции, катализируемой ферментом карбоангидразой:
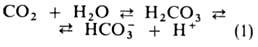
Гидрокарбонат-ионы в эритроцитах замещаются далее на ионы Cl- из плазмы, сами переходят в плазму и переносятся ею к легким. Определенная часть СО2 связывается в эритроцитах с N-концевыми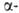 аминогруппами гемоглобина с образованием остатка карбаминовой к-ты, уменьшая сродство гемоглобина к О2. Увеличение РСО2 т-ры, ионной силы р-ра и уменьшение рН снижают сродство гемоглобина к О2. Важнейший внутриэритроцитарный регулятор сродства - анионы 2,3-дифосфоглицериновой к-ты. Увеличение их концентрации также уменьшает сродство гемоглобина к О2. Снижение сродства при уменьшении рН в интервале 9-6 наз. щелочным эффектом Бора, к-рый обусловлен существованием равновесия:
аминогруппами гемоглобина с образованием остатка карбаминовой к-ты, уменьшая сродство гемоглобина к О2. Увеличение РСО2 т-ры, ионной силы р-ра и уменьшение рН снижают сродство гемоглобина к О2. Важнейший внутриэритроцитарный регулятор сродства - анионы 2,3-дифосфоглицериновой к-ты. Увеличение их концентрации также уменьшает сродство гемоглобина к О2. Снижение сродства при уменьшении рН в интервале 9-6 наз. щелочным эффектом Бора, к-рый обусловлен существованием равновесия:
Этот эффект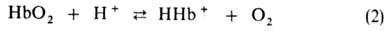 вносит значит. вклад в поддержание постоянного значения рН крови и освобождение О2 в тканях соотв. уровню обмена в-в [увеличение концентрации СО2 сдвигает равновесие р-ций (1) и (2) вправо]. В легких, где рСО2 составляет 40 мм рт. ст., процессы, описываемые р-циями (1) и (2), идут в обратном направлении, в результате чего СО2, находящийся в растворенном и связанном с гемоглобином состоянии, освобождается, гемоглобин оксигенируется и дыхат. цикл завершается.
вносит значит. вклад в поддержание постоянного значения рН крови и освобождение О2 в тканях соотв. уровню обмена в-в [увеличение концентрации СО2 сдвигает равновесие р-ций (1) и (2) вправо]. В легких, где рСО2 составляет 40 мм рт. ст., процессы, описываемые р-циями (1) и (2), идут в обратном направлении, в результате чего СО2, находящийся в растворенном и связанном с гемоглобином состоянии, освобождается, гемоглобин оксигенируется и дыхат. цикл завершается.
У человека на разных этапах развития организма обнаружено несколько гемоглобинов, различающихся составляющими их субъединицами. На ранних стадиях эмбрионального развития у зародыша обнаруживаются гемоглобины строения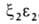 ,
,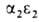 ,
,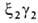 . На более поздних стадиях появляется и доминирует к моменту рождения HbF (
. На более поздних стадиях появляется и доминирует к моменту рождения HbF (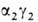 ; т. наз. фетальный гемоглобин). Св-ва эмбриональных гемоглобинов обеспечивают выполнение кисло-родтранспортной ф-ции в специфич. условиях внутриутробной жизни. В эритроцитах взрослого человека содержится в норме 95-97% НЬА
; т. наз. фетальный гемоглобин). Св-ва эмбриональных гемоглобинов обеспечивают выполнение кисло-родтранспортной ф-ции в специфич. условиях внутриутробной жизни. В эритроцитах взрослого человека содержится в норме 95-97% НЬА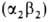 , начинающего преобладать через 2-3 месяца после рождения, и 2-3% НbА2
, начинающего преобладать через 2-3 месяца после рождения, и 2-3% НbА2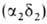
Первичные структуры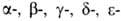 и
и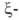 полипептидных цепей гемоглобина человека, а также мн. др. глобиновых цепей разл. происхождения известны. Гены, кодирующие
полипептидных цепей гемоглобина человека, а также мн. др. глобиновых цепей разл. происхождения известны. Гены, кодирующие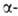 глобиновые цепи гемоглобина человека, сцеплены и расположены в последовательности
глобиновые цепи гемоглобина человека, сцеплены и расположены в последовательности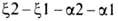 на хромосоме 16 (цифры-номера дуплицированных генов); группа генов, кодирующих др. полипептидные цепи, также непосредственно примыкающие один к другому
на хромосоме 16 (цифры-номера дуплицированных генов); группа генов, кодирующих др. полипептидные цепи, также непосредственно примыкающие один к другому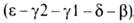 , локализована на хромосоме 11. Первичная структура
, локализована на хромосоме 11. Первичная структура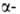 и не
и не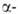 глобиновых генов человека известна. Для каждого из них установлено наличие двух нитронов (отрезков ДНК, прерывающих кодирующие участки,-экзоны) и больших некодирующих участков, находящихся на флангах генов. Биосинтез гема,
глобиновых генов человека известна. Для каждого из них установлено наличие двух нитронов (отрезков ДНК, прерывающих кодирующие участки,-экзоны) и больших некодирующих участков, находящихся на флангах генов. Биосинтез гема,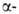 и
и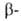 глобиновых цепей, а также сборка тетрамерных молекул НbА осуществляется в клетках эритроцитарного ряда и практически завершается к моменту выхода зрелых эритроцитов (их продолжительность жизни у человека составляет 120-130 дней) из костного мозга в кровяное русло.
глобиновых цепей, а также сборка тетрамерных молекул НbА осуществляется в клетках эритроцитарного ряда и практически завершается к моменту выхода зрелых эритроцитов (их продолжительность жизни у человека составляет 120-130 дней) из костного мозга в кровяное русло.
Точковые мутации в экзонах глобиновых генов могут вести к появлению мутантных гемоглобинов с единичной аминокислотной заменой. Это м. б. причиной молекулярных болезней — наследств. гемоглобинопатий. наиб. известный пример мутантного гемоглобина- HbS, в к-ром шестой от N-конца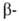 глобиновой цепи остаток глутаминовой к-ты заменен на остаток валина. Такой гемоглобин содержится в эритроцитах больных серповидноклеточной анемией. Точечная мутация, делеция (выпадение участка ДНК) или другой дефект глобинового гена, локализованный вне экзонов, может уменьшить продукцию глобиновых цепей в эритроцитах, нарушить сбалансированный биосинтез
глобиновой цепи остаток глутаминовой к-ты заменен на остаток валина. Такой гемоглобин содержится в эритроцитах больных серповидноклеточной анемией. Точечная мутация, делеция (выпадение участка ДНК) или другой дефект глобинового гена, локализованный вне экзонов, может уменьшить продукцию глобиновых цепей в эритроцитах, нарушить сбалансированный биосинтез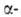 и
и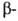 цепей и привести к др. распространенной разновидности гемоглобинопатий-талассемии.
цепей и привести к др. распространенной разновидности гемоглобинопатий-талассемии.
Литература
Уайт А., Хендлер Ф., Смит Э., Основы биохимии, пер. с англ., т. 3, М, 1981, с. 1218-66; Bunn Н. F., Forget В. G., Ranney Н. М, Нетоglobinopathies, Phil.- L.- Toronto, 1977; Human hemoglobins and hemoglobinopathies, "Texas Reports on Biology and Medicine", 1980-1981, v. 40; Atlas of molecular structures in bioldgy, ed. by D.C. Philips, P.M. Richards, v. 2, Haemoglobin and myoglobin, ed. by G. Fermi and M.F. Perutz, Oxf., 1981; Methods in enzymology, v. 76-Hemoglobins, N. Y.- L.- [a. o.], 1981. B.A. Спивак.
