Координациoнная связь
КООРДИНАЦИOННАЯ СВЯЗЬ, хим. связь в комплексных соединениях, в к-рых один или неск. атомов образуют большее число связей, чем допускает высшая формальная валентность этих атомов. Различают двухцентровые (донорно-акцепторные) и многоцентровые координационные связи. К первым относят связи, образование к-рых (формирование заполненной двумя электронами связывающей двухцентровой мол. орбитали) можно описать как передачу электронной пары, локализованной на одном из атомных центров лиганда (донора), на своб. орбиталь атома-комплексообразователя (акцептора). Такие координационные связи способны образовывать атомы как непереходных, так и переходных элементов, но более характерны они для последних, т. к. их вакантные d- и f-орбитали имеют низко расположенные энергетич. уровни, что облегчает акцептирование электронных пар с валентных орбиталей лиганда. Примеры двухцентровых координационных связей-связи В—N в боразане (ф-ла I), связи Fe—С, Ti—О, Со—N в комплексных ионах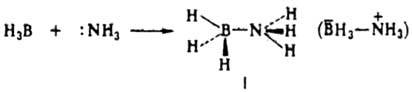
[Fe(CN)6]4-, [Ti(H2O)6]3+, [Co(NH3)6]3+. Природа таких связей не отличается от природы обычной полярной ковалентной связи (см. Химическая связь). Различны лишь способы их образования. В случае координационной связи электронная пара связи поставляется одним из взаимодействующих центров (лигандом). Ковалентная связь формируется валентными электронами обоих взаимодействующих центров. Однотипность этих видов хим. связи наглядно проявляется, напр., в том, что образование новой связи N—Н в ионе аммония NH4+ при протонировании аммиака можно рассматривать как возникновение координационной связи. К координационным должны быть причислены и т. наз. семиполярные связи типа
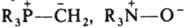 , образование к-рых обычно описывают как предварит, перенос одного электрона от донора к акцептору с послед. спариванием неподеленных электронов и формированием общей связывающей орбитали. Частный случай координационной связи - водородная связь. В случае многоцентровой координационной связи результирующая мол. орбиталь делокализована. Примеры многоцентровых координационных связей-трехцентровые мостиковые связи В—Н—В в боранах, М—Сl—М в кристаллах и ассоциатах галогенидов металлов:
, образование к-рых обычно описывают как предварит, перенос одного электрона от донора к акцептору с послед. спариванием неподеленных электронов и формированием общей связывающей орбитали. Частный случай координационной связи - водородная связь. В случае многоцентровой координационной связи результирующая мол. орбиталь делокализована. Примеры многоцентровых координационных связей-трехцентровые мостиковые связи В—Н—В в боранах, М—Сl—М в кристаллах и ассоциатах галогенидов металлов: 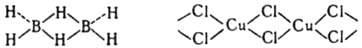
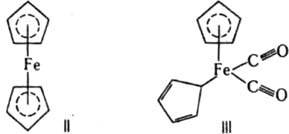
При образовании координационных связей с лигандами, имеющими энергетически низко расположенные вакантные p-орбитали (СО, CN-, нек-рые циклы с сопряженными связями), важную роль играют дополнит. донорно-акцепторные связи p-типа (см. Кратные связи), в к-рых p-орбитали лиганда заселяются электронной парой с p-орбитали центр, атома -т. наз. дативные связи. Такие связи
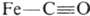 реализуются в комплексе ф-лы III. Образование координационной связи при координации сопряженных соед. на атоме металла ведет к значит. поляризации связей лиганда и их активации по отношению к нуклеоф. агентам. Этим определяется существо металлокомплексного катализа, позволяющего резко повысить реакц. способность мало реакционноспособных олефинов, связей С—Н и др. Во многих орг. р-циях промежут. образование соединений с координационными связями, напр. p-комплекса (IV) при электроф. присоединении, также является важной стадией механизма р-ции:
реализуются в комплексе ф-лы III. Образование координационной связи при координации сопряженных соед. на атоме металла ведет к значит. поляризации связей лиганда и их активации по отношению к нуклеоф. агентам. Этим определяется существо металлокомплексного катализа, позволяющего резко повысить реакц. способность мало реакционноспособных олефинов, связей С—Н и др. Во многих орг. р-циях промежут. образование соединений с координационными связями, напр. p-комплекса (IV) при электроф. присоединении, также является важной стадией механизма р-ции: 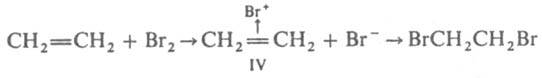
Многообразие типов координационной связи обусловливает разнообразие структурных типов молекул координационных соед., а также кристаллич. структур твердых тел. Лучший способ описания координационной связи и строения координационных соед. - метод мол. орбиталей. Однако полные расчеты таких соед. сопряжены нередко с большими вычислит. трудностями. Поэтому для объяснения и предсказания св-в координационных соед. во многих случаях целесообразно использовать методы, основанные на более простых физ. моделях. К последним относятся теории кристаллич. поля и поля лигандов.
Литература
Минкин В. И., Симкин Б. Я., Миняев Р. М., Теория строения молекул, М., 1979; Берсукер И. Б., Электронное строение и свойства координационных соединений, 3 изд., Л., 1986. В. И. Минкин.
Синонимы/примеры:*
Донорно-акцепторная связь; дативная связь
*подобраны ИИ, возможны неточности
Ещё по теме
Координационная связь — механизм образования и примеры
Комплексные соединения — строение, свойства и применение
Полиядерные соединения в химии — структура и свойства
Комплексные соединения в химии — строение и свойства
Гетерополярные химические связи — типы и особенности
Тройная связь в химии
Гибридизация орбиталей и химические связи
Комплексные соединения — механизмы образования и устойчивость
Ковалентная и ионная связи — особенности и отличия
Донорно-акцепторная связь в химии
Кумулированные связи в органической химии
Простая ковалентная связь в химии
