Полиядерные соединения
ПОЛИЯДЕРНЫЕ СОЕДИНЕНИЯ (многоядерные соед.), координац. соед., в молекулах которых имеется неск. атомов металлов, окруженных лигандами и связанных друг с другом посредством мостиковых групп. Наиб. изучены би-и триядерные координац. соединения. Когда число атомов металлов велико, такие соед. наз. координационными или металлсодержащими полимерами, металлополимерами (см. Координационные полимеры). Соотношение между полиядерными соединениями и координац. полимерами такое же, как и между мономерами (и олигомерами) и полимерами в карбоцепных высокомол. соединениях. К полиядерным соединениям иногда относят соед., содержащие ячейки из непосредственно связанных друг с другом атомов металлов, обычно наз. кластерами. Различают гомо- и ге-терометаллические полиядерные соединения. Расстояния металл-металл в полиядерных соединениях варьируют в широких пределах, иногда могут достигать 1 нм и более.
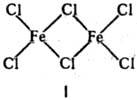
Число известных полиядерных соединений огромно. Прир. и пром. р-ры ионов металлов, как правило, содержат полиядерные соединения. Многие координац. соед. в паровой фазе также имеют строение полиядерных соединений, напр. Fе2С16 (ф-ла I).
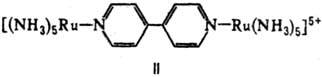
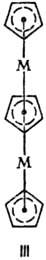
Биядерные координац. соед. по структуре удобно классифицировать по числу мостиковых групп, связывающих моноядерные фрагменты. При одной мостиковой группе связь М— . —М м. б. линейной (плоской), напр. LM—F—ML, соед. II, III, или изогнутой-соед. IV (X = С1, Вг, Д V.
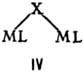
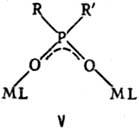
При двух мостиковых группах часто реализуется устойчивый плоский квадрат-соед. VI.
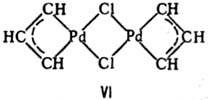
Макс. число мостиковых групп между двумя атомами металлов 4.
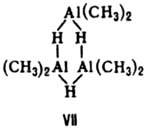
Триядерные координац. соед. могут иметь линейное или циклич., напр соед. VII, строение.
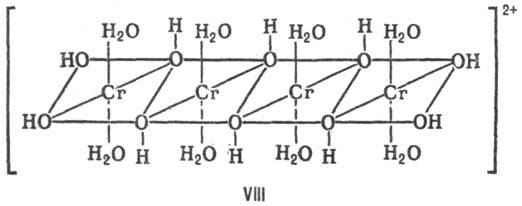
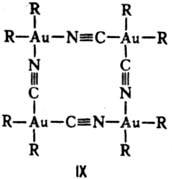
В тетраядерных координац. соед. атомы металлов могут выстраиваться в цепь, напр. соед. VIII, образовать цикл (соед. IX) или тетраэдр (соед. X).
 J
J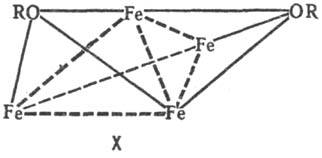
С увеличением числа атомов металлов в полиядерных соединениях число возможных типов структур и их сочетаний увеличивается. Олигомеры с числом атомов металлов п = 5-15 часто имеют глобулярное строение, типичный пример-анионы гетерополикислот.
В р-рах полиядерные соединения образуются при наличии полидентатных лигандов и избытка ионов металлов. Поскольку образующиеся из молекулы воды лиганды полидентатны (ОН-бидентатный и О-тридентатный), то в водных р-рах солей металлов всегда имеет место в той или иной степени полиядерное комплексообразование, усиливающееся также благодаря образованию мостиковых водородных связей. Для идентификации и изучения полиядерных соединений в р-рах используют спектрофотометрию, разл. варианты радиоспектроскопии, в т.ч. ядерную магн. релаксацию.
Гидролиз - один из осн. путей образования полиядерных соединений. Характерный пример-укрупнение комплексов Bi:
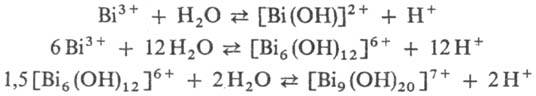
Практически все многозарядные катионы образуют в водных р-рах полиядерные соединения в соответствующей области рН. Так, в р-рах Sn(II) всегда присутствует катион [Sn2(OH)2]2+, а также [Sn3(OH)4]2+, в к-ром атомы Sn образуют треугольник Sn3 с расстоянием Sn—Sn ~ 0,36 нм. Аналогично существование полиядерных соединений в р-рах Pt(II) доказано выделением соли [Pt4(OH)4](ClO4)4·2H2O, катион Pt4(OH)4 имеет форму куба. Однако многие би-, три- и тетраядерные комплексы получены только в определенных эмпирически найденных условиях, при определенных соотношениях реагентов, р-ри-телей и т.п.
Чаще всего полиядерные соединения получают путем связывания части лигандов в моноядерных комплексных соед., напр.:
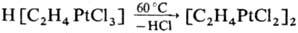
Др. путь-р-ции функц. групп в лиганде, напр.:
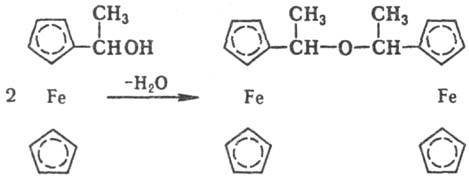
Реакц. способность полиядерных соединений в большинстве простейших р-ций, характерных для координац. соед., таких, как окислит.-вос-становит. р-ции, замещение лигандов, обмен лигандами во внеш. сфере и т.п., мало чем отличается от реакц. способности моноядерных комплексов с теми же лигандами.
Типичная для полиядерных соединений р-ция-расщепление мостиковых связей с образованием, как правило, моноядерных координац. соединений:
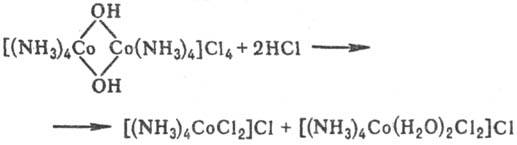
Одно из наиб. характерных св-в полиядерных соединений-внутримол. электронный обмен, исследуемый такими методами, как ЯМР, метод остановленной струи, электрохимические и т.д. Найдено, что по мере уменьшения расстояния между ионами и увеличения электронной проводимости лигандов скорость обмена возрастает на неск. порядков.
Особый интерес представляют магн. св-ва полиядерных соединений. Ряд магнитных полиядерных соединений образует диэлектрич. кристаллы, содержащие в качестве структурных элементов решетки ионы переходных металлов, участвующие в обменных взаимодействиях друг с другом; они эффективно экранированы лигандами от др. парамагн. центров. Такие системы иногда наз. "обменными кластерами". Они оказались удобными модельными системами для исследования обменных взаимодействий и создания микроскопич. теории магнетизма.
Отдельные типы полиядерных соединений находят практич. применение в качестве эффективных катализаторов, разл. материалов (магн., диэлектрич., полупроводниковых).
Лит.: Хайдук И., "Успехи химии", 1961, т. 30, в. 9, с. 1124-74; Харгит-таиМ., ХаргиттаиИ., Геометрия молекул координационных соединений в парообразной фазе, пер. с англ., М., 1976; Цукерблат Б. С., Белинский М. И., Магнетохимия и радиоспектроскопия обменных кластеров, Киш., 1983; Burgess J., Metal ions in solution, Chichester-N. Y., 1978. С.П. Губин.
