Понятие о связи атомов в молекуле
Из учения о валентности вытекает понятие о связи атомов между собой. В органических веществах атомы разных элементов связаны в молекуле непосредственно друг с другом по правилу валентности. Наиболее часто непосредственная связь обозначается черточками, соединяющими буквенные обозначения атомов. Так, связи между атомами в молекулах водорода, хлористого водорода, воды, аммиака и метана изображаются следующим образом:
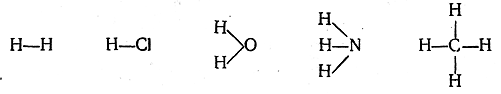
Такое изображение означает, что, например, в молекуле воды каждый атом водорода непосредственно связан с атомом кислорода, но что атомы водорода между собой непосредственно не связаны, аудерживаются в молекуле исключительно благодаря атому кислорода. Связь между атомами водорода в молекуле воды не прямая, а посредственная.
Возможность усложнения молекулы благодаря присутствию многовалентных элементов. Атомы одновалентных элементов могут быть непосредственно связаны только с каким-нибудь одним атомом. Атомы же многовалентных элементов могут быть непосредственно связаны с разными атомами. Так, например, если атом трехвалентного азота связан с атомом двухвалентного кислорода, то остальные связи азота икислорода могут быть затрачены на соединение с атомами водорода:
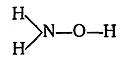
Именно такая последовательность связи атомов имеется всоединении, известном под названием гидроксиламина.
В молекуле перекиси водорода Н2О2 два атома кислорода связаны между собой, и каждый из них в свою очередь связан еще с атомом водорода. Последовательность связи атомов в молекуле перекиси водорода, в соответствии с правилами валентности, изображается формулой
H—O—O—H
Аналогичным образом можно представить себе, что между собой связаны два атома углерода. Тогда с этими углеродными
атомами могут быть соединены еще шесть атомов водорода (по три атома водорода с каждым углеродным атомом). Строение молекулы С2Н6 в таком случае выразится формулой со следующим порядком связи атомов:
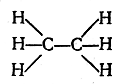
Если далее представить себе ряд из трех атомов углерода, соединенных между собой непосредственной связью, а оставшимися валентностями связанных с атомами водорода, то получится следующий порядок связи атомов в молекуле С3Н8:
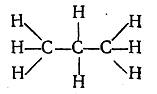
Возможность различия молекул вследствие различной последовательности связи атомов (изомерия). К цепи из. трех атомов углерода четвертый углеродный атом может быть присоединен двояким образом: а) к одному из двух крайних атомов и б) к среднему атому. При последующем присоединении атомов водорода, число которых должно соответствовать четырехвалентности углеродных атомов, возможен не один, а два различных порядка связи атомов в молекулах общей формулы С4Н10:
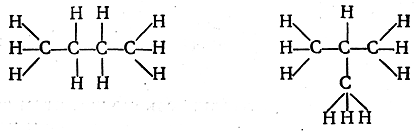
Таким образом, если допустить, что между собой могут быть непосредственно связаны не только разнородные атомы, но и атомы одного и того же элемента, то учение о валентности приводит к заключению, что молекулы, не отличающиеся между собой ни качеством, ни числом входящих в них атомов, могут отличаться порядком связей между атомами. В данном случае следует признать, что эмпирической формулой С4Н10 могут обладать два вещества, имеющие одинаковый качественный и количественный состав, а также одинаковый молекулярный вес, но отличающиеся порядком химической связи атомов в молекулах (химическим строением). Такие два вещества называются изомерными веществами или, кратко, изомерцми.


