§ 3. Комплексные соединения
Владея материалом предыдущих параграфов и разделов курса, можно провести несколько более углубленное рассмотрение комплексных соединений, чем то было сделано ранее (IX § 2). Хотя основы современной трактовки этой обширной и важной части общей химии были заложены довольно давно (Вернер, 1893 г.) и систематика комплексных соединений разработана очень подробно, однако свойства их изучены еще весьма неполно. Поэтому взаимосвязь между строением комплексных соединений и их свойствами может быть пока намечена лишь в общих чертах.
Если первоначально ограничиться комплексами с ионными аддендами (комплексно присоединенными частицами), то прежде всего бросается в глаза аналогия способов образования между такими комплексами и некоторыми кислородными соединениями, как это видно, например, из приводимых ниже сопоставлений:
Н2 О + SO3 = H2 [SO4 ]
К2 О + SO3 = K2 [SO4 ]
2HCl + PtCl2 = H2 [PtCl4 ]
2KCl + PtCl82 = K2 [PtCl4 ]
Кислородные кислоты и их соли можно, следовательно, считать Устным случаем комплексов рассматриваемого типа (так называемых ацидокомплексов). Наряду с кислородом, хлором и другими элементарными отрицательными ионами в качестве аддендов при образовании ацидокомплексов (т. е. соединений с комплексным анионом) могут фигурировать и такие кислотныерадикалы, как CN–, NO2 –, NO3 –, СО3 2–, SO3 2–, SO4 2–и др. С другой стороны, комплексообразователями могут быть очень многие элементы и притом нередко в различных валентных состояниях. Поэтому число известных ацидо–комплексов весьма велико и состав их довольно разнообразен, как это видно, например, из приводимого сопоставления для фторидов (М – одновалентный металл).

Тот или иной структурный тип сказывается на свойствах комплексного соединения часто даже в большей степени, чем химическая природа его составных частей. Сам этот тип характеризуется прежде всего координационным числом комплек–сообразователя. Последнее, вообще говоря, переменно и, помимо природы самого комплексообразо–вателя и аддендов, зависит также от условий, при которых происходит образование комплекса (главным образом концентраций составных частей и температуры).
Опыт показывает, однако, что для многих комплексообразователей име ются определенные типы структур, которые предпочтительно образуются при разнообразных аддендах и различных их концентрациях. Это дает основание говорить о координационных числах, характерных (при обычных условиях) для подобных комплексообразователей. Например, для Со3+ и Pt4+характерно координационное число 6, а для Pt2+– число 4.
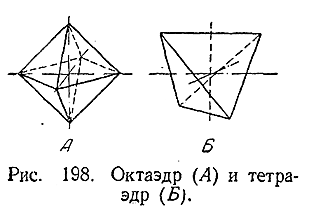
Из сопоставления опытного материала по комплексным соединениям вытекает, что наиболее обычными являются структуры, отвечающие координационным числам 6 и 4. Все другие значения координационных чисел встречаются гораздо реже.
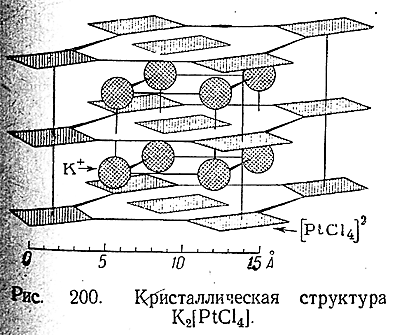
Пространственная структура внутренней сферы комплекса определяется, в основном, координационным числом и стремлением к достижению максимальной компактности (плотности) упаковки частиц. Если представить себе комплексообразова–тель находящимся в центре соответствующей фигуры, то для координационного числа 6 характерно расположение адден–дов по углам октаэдра (рис. 198, Л), а для координационного числа 4 – по углам тетраэдра (рис. 198, Б). Октаэдрическое расположение аддендов было установлено, в частности, для иона (PtCl6 ]2–(рис. 199). При координационных числах 4 и ниже значительную роль для относительной устойчивости того или иного пространственного расположения играют индивидуальные особенности комплексообразователя и аддендов. Поэтому, например, для координационного числа 4, кроме тетраэдрического, стано вится возможным и расположение аддендов по углам квадрата (с комплексообразователем в центре характерное, в частности, для производных двухвалентной платины (рис. 200).
Наряду с противоположно заряженными ионами комплексообразователем могут быть притянуты и такие молекулы, как NH3 , Н2 О и т. п. Вследствие нейтральности аддендов образующиеся в этом случае комплексные ионы сохраняют тот же заряд, который имел комплексообразователь. Так как последним обычно является катион, для комплексов с нейтральными аддендами характерно наличие по преимуществу комплексных катионов.
Из рассмотренного ранее (IX § 2) вытекает, что типичными комплексообразователями должны быть многозарядные ионы со сравнительно небольшим объемом. Так как элементарные анионы характеризуются небольшими зарядами и довольно значительными объемами, роль комплексообразователя для них мало характерна. Однако отдельные представители подобных комплексов все же известны. Например, растворением AgJ в концентрированном растворе AgNO3 можно получить двойное соединение AgJ·2AgNO3 , результаты изучения которого указывают на структуру [JAg3 ]K(NO3 )2 с ионом J–в качестве комплексообразователя.
Выше рассматривались комплексные соединения, которые вследствие одинаковости всех аддендов могут быть названы однородными. Гораздо многочисленнее неоднородные комплексы, характеризующиеся одновременным наличием во внутренней сфере двух или более различных аддендов.
Очевидно, что замена ионного адденда на нейтральный или обратно должна сказаться на заряде комплексного иона в целом. Исходя, например, из [Pt(NH3 )6 ]4+ и последовательно замещая в нем молекулы аммиака на ионы Сl", получим следующий ряд комплексных катионов:
[Pt(NH3 )6 ]4+
[Pt(NH3 )5 Cl]3+
[Pt(NH3 )4 Cl2 ]2+
[Pt(NH3 )3 Cl3 ]+
Замена еще одного аммиака на Сl– ведет к образованию нейтрального комплекса [Pt(NH3 )2 Cl4 ]. Наконец, при замещении последних двух молекул аммиака получаются комплексные анионы [Pt(NH3 )Cl5 ]–и [PtCl6 ]2–.
Замена во внутренней сфере одних аддендов другими часто сопровождается отчетливым изменением окраски комплекса, как это видно, например, из приводимого ниже ряда хлористых солей с катионом [СrА6 ]3+, где A = NH3 или Н2 О:
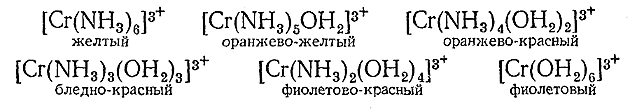
Соединение состава {Cr(NH3 ) (ОН2 )5 ]Сl3 не получено. Судя по ходу изменения цветности, оно должно быть красно–фиолетовым.
Помимо отвечающего эмпирической формуле CrCl3 ·6H2 O фиолетового соединения, известны еще два кристаллогидрата того же состава – светло–зеленый и темно–зеленый. На примере этих трех веществ мы впервые встречаемся с изомерией комплексных соединений, т. е. существованием среди них тождествнных по составу, но различных по структуре образований (X § 2).
Решение вопроса о характере изомерии гидратов СrСl3 возможно на основании различного отношения их свежеприготовленных растворов к AgNO3 . При действии этого реактива фиолетовое соединение выделяет в осадок сразу все три иона хлора, светло–зеленое – два, а темно–зеленое – только один. Основываясь на этих результатах опыта и имея в виду характерность для Сr3+ координационного числа шесть, рассматриваемым изомерным кристаллогидратам следует, очевидно, приписать структуры:
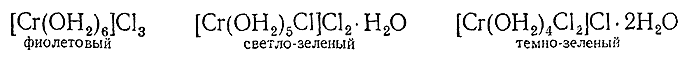
С приведенными формулами хорошо согласуется также то обстоятельство, что при стоянии в эксикаторе над серной кислотой фиолетовый кристаллогидрат вовсе не обезвоживается, а темно–зеленый отщепляет только две молекулы воды.
Подобная изомерия, зависящая от различного расположения молекул воды (гидратная изомерия), известна для ряда соединений. Близко к ней стоит ионизационная изомерия, связанная с различной легкостью диссоциации ионов из внутренней и внешней сфер. Например, для соединения состава Co(Br)SO4 ·5NH3 известны два изомера – красно–фиолетовый и красный. Свежеприготовленный раствор первого из них не дает осадка с ионами Ag+, но дает его с ионами Ва2+, раствор второго – наоборот. Отсюда вытекает, что обоим изомерам отвечают следующие структуры:

У соединений с двумя комплексными ионами в молекуле возможно наличие координационной изомерии, связанной с различным распределением аддендов между обоими комплексообра–зователями. Примерами могут служить соединения:
[Co(NH3 )6 ] [Cr(CN)6 ] и [Cr(NH3 )6 ] [Co(CN)6 ]
Несколько особняком от только что рассмотренных стоят случаи изомерии, обусловленные различным пространственным расположением аддендов неоднородного комплекса в одной и той же внутренней сфере. Сюда в первую очередь относится так называемая цис–транс–изомеры.
Например, соединение состава [Pt(NH3 )2 Cl2 ] способно существовать в двух формах, из которых одна имеет оранжево–желтый, а другая – светло–желтый цвет. Помимо окраски, обе формы отличаются друг от друга и способом образования и рядом свойств. Ближайшее изучение последних указывает на то, что структурам обоих изомеров отвечает различное расположение аддендов з квадратной внутренней сфере (характерной для комплексных производных двухвалентной платины) друг относительно друга, как это видно из приводимых ниже схем:
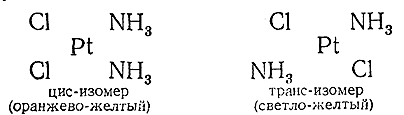
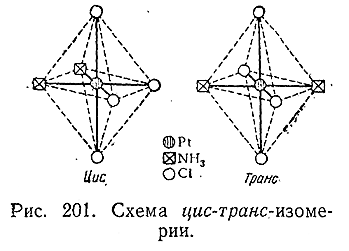
Оба эти соединения способны присоединять по два атома хлора (с повышением валентности платины до четырех и ее координационного числа до шести), причем продуктами взаимодействия оказываются опять–таки вещества с различными свойствами. В частности, цис–изомер имеет оранжевую окраску, а транс–изомер – желтую. Структура того и другого схематически показана на рис. 201. Совершенно подобная же изомерия известна для ряда других комплексов с шестью аддендами, из которых два отличаются от четырех других. При наличии во внутренней сфере трех и т. д. разных типов аддендов число возможных пространственных изомеров еще повышается.
Так как с комплексными соединениями приходится обычно иметь дело в водных растворах, наиболее часто встречающейся реакцией замещения во внутренней сфере является ее гидратация. Последняя идет постепенно, причем положение равновесия и скорость процесса могут до некоторой степени служить мерой относительной прочности связи адденда с данным центральным атомом. Зная, например, что в комплексе [Со(NH3 )3 Х3 ], где X = NO2 –, Cl–или NO3 – первый из этих кислотных остатков (равно как и аммиак) водой не замещается, второй замещается частично, а третий – нацело, можно сказать, что NH3 и NO2 – связаны с Со3+ прочнее, чем Сl–,
а последний прочнее, чем МОГ.
Практически чаще всего приходится иметь дело с взаимным замещением NH3 и Н2 О, протекающим) по суммарной схеме:
[Э(NH3 )x] + xH2 O < = > [Э(OH2 )x + xNH3
Положение равновесия этой системы определяет большую или меньшую устойчивость аммиакатов в водном растворе. То обстоятельство, что для отдельных комплексообразователей она весьма различна, широко используется в аналитической химии.


