Координационная связь
Наиболее часто ковалентная связь образуется за счет обобщения электронов, ранее принадлежавших двум отдельным атомам, например:
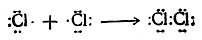
Однако возможен и иной механизм образования ковалент-ной связи. Так, при присоединении протона к аммиаку образуется ион аммония, в котором вновь образовавшаяся связь N—Н ковалентна и ничем не отличается от трех остальных, имевшихся в исходной молекуле аммиака. Эта четвертая связь N—Н могла образоваться только за счет неподеленной, или свободной, электронной пары азота аммиака:
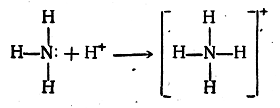
Вновь образовавшаяся ковалентная связь N—Н ничем не отличается от трех остальных связей, кроме своего происхождения.
Сходным путем, при взаимодействии смеси фтористого этила и трехфтористого бора с простым эфиром за счет свободной электронной пары кислорода образуется ковалентная связь О—С2Н5 в ионе триэтилоксония:
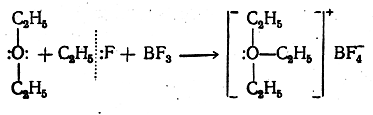
При реакции трехфтористого бора с анионом фтора четвертая ковалентная связь В—F в анионе BF4- образуется за счет неподеленной электронной пары иона фтора:
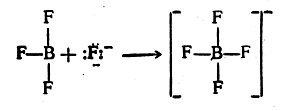
И здесь вновь образовавшаяся ковалентная связь В—F ничем не отличается от трех других, как и в случае симметрично построенного катиона аммония.
Ковалентную связь, образующуюся за счет электронной пары только одной из реагирующих частиц, по предложению Льюиса и Сиджвика называют координационной (иначе — донорно-акцепторной) связью. Атом или ион, отдающий свою электронную пару для образования такой связи, называется донором (атом азота — в первой реакции, атом кислорода — во второй и анион фтора — в третьей). Атом или ион с незаполненной внешней электронной оболочкой, обобщающий чужую электронную пару, называется акцептором (протон — в первой реакции, этил-катион — во второй, атом бора — в третьей).
Координационная связь может образовываться также при соединении двух молекул, например:
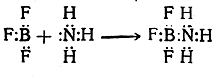
В этой реакции BF3, как и протон в реакции (1) и этил-катион в реакции (2), образует новую связь за счет электронной пары реагирующего с ним вещества. Такие реагенты (BF3, Н+ ) называются электрофильными или электроноакцепторными (реже— катионоидными). Аммиак в реакциях (1) и (4), диэтило-вый эфир в реакции (2) и анион фтора в реакции (3) образуют новую связь за счет своей неподеленной электронной пары. Такие реагенты называются нуклеофильными или электронодонорными (реже—анионоидными).
Так как связь В—N в реакции (4) образуется путем обобщения электронной пары, ранее принадлежавшей азоту, простой арифметический подсчет показывает, что на атоме азота должен появиться положительный, а на атоме бора — отрицательный заряд (так называемые формальные заряды). Поэтому соединение BF3 с NH3 можно также изобразить следующим образом:
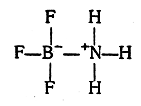
При таком написании соединения BF3 с NH3 становится понятным, что координационная связь В—N может быть названа также семиполярной (полуполярной), так как она представляет собой как бы сочетание ковалентной и электровалентной связей. Координационная связь, образующаяся при соединении двух указанных молекул, несколько отличается от ковалентных связей в симметричных ионах NH4 и BF4- вследствие отсутствия полной симметричности образовавшейся молекулы. Это отличие выражается, например, в повышенном дипольном моменте (2,4—3,5D). Поэтому для изображения такой связи часто применяют другие графические приемы, чем приизображении остальных типов ковалентных связей. Так, соединение BF3 с NH3 может быть изображено следующими способами:
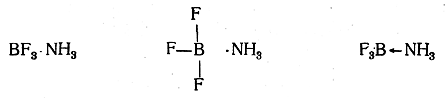
Последний способ изображения отражает донорно-акцепторный механизм образования координационной связи (предоставление атомом азота электронной пары для образования связи).
Огромное число примеров координационной связи дает химия комплексных соединений. Таковы, например, комплексы:
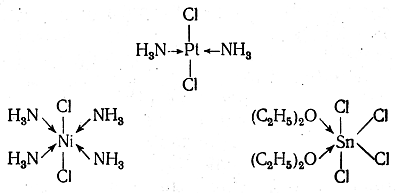
Примерами весьма распространенных в органической химии семиполярных связей могут служить связи азота с кислородом в окисях аминов инитросоединениях. Для того чтобы выяснить их строение, рассмотрим две химические реакции, применяя вначале обычные, неэлектронные структурные формулы. Одна реакция — окисление третичного амина перекисью водорода вокись амина
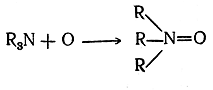
вторая — окисление нитрозосоединения в нитросоединение:
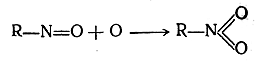
Если теперь изобразить электронное строение полученных соединений, заменив валентные черточки электронными парами
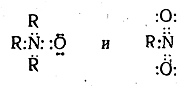
то легко видеть, что в каждом из этих соединений атом азота окружен не восемью, а десятью электронами, и, следовательно, изображенные нами электронные и соответствующие им классические структурные формулы с точки зрения октетной теории неверны. Для того чтобы выполнялось правило октета, необходимо иное распределение электронов, например:
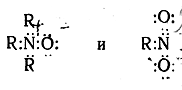
Арифметический подсчет электронов вэтом случае показывает, что в окиси амина азот заряжен положительно, а кислород— отрицательно; внитросоединении азот заряжен положительно, а один из атомов кислорода — отрицательно. Обычно сокращенная запись таких формул производится следующим образом:

В приведенных формулах нитросоединения связи азота с кислородом неравноценны. В действительности же, как показывают результаты физических исследований, эти связи энергетически совершенно одинаковы и, следовательно, электронная пара, обусловливающая отрицательный заряд, не сосредоточена целиком на каком-либо одном кислородном атоме, а несколько смещена к азоту при одновременном смещении от азота ко второму кислородному атому одной из электронных пар (π-элек-тронной пары) двойной связи.
Эти смещения электронных пар ограничены требованиями, согласно которым вокруг каждого из трех рассматриваемых атомов должно быть внешнее электронное облако с зарядом, равным заряду восьми электронов, и, кроме того, обе связи N—О должны быть равноценны по электронной плотности. Эти требования обычно отражаются следующим образом:
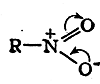
Изогнутыми стрелками, показывающими направления смещения электронов, исправляется несимметричная формула нитрогруппы, которую мывывели, опираясь только на правило октета.
Примером соединений с семиполярными связями могут также служить эфиры сульфоновых (сульфиновых) кислот
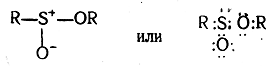
и сульфоокиси:
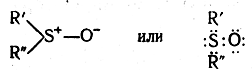
Эфиры сульфоновых кислот и несимметричные сульфоокиси могут быть расщеплены на оптические антиподы. Этот факт вполне согласуется с предположением о наличии у этих соединений семиполярных связей, так как только в таком случае атом серы имеет свободную электронную пару, облако которой направлено в пространстве совершенно определенным образом, играя роль четвертого, отличного от трех других заместителя; это и приводит, аналогично соединениям с асимметрическим атомом углерода, к появлению оптической изомерии у эфиров сульфоновых кислот и несимметричных сульфоокисей.
Вопрос о том, имеются ли семиполярные связи у высших окислов и кислородных кислот серы, фосфора и галоидов, например
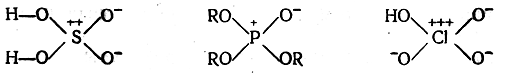
или же такие соединения содержат двойные связи
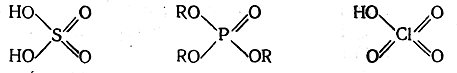
в настоящее время еще окончательно не решен.
Против наличия в таких молекулах семиполярных связей свидетельствует то, что длина связей приближается к длине обычных двойных связей, в то время как длина семиполярных связей близка к длине простых связей; дипольные моменты рассматриваемых соединений значительно меньше дипольных моментов, рассчитанных при допущении семиполярных связей; связи серы, фосфора и хлора с кислородом в рассматриваемых соединениях прочнее, чем типичные семиполярные связи.
Существование семиполярных связей вытекает из необходимости соблюдения правила октета. Однако, по-видимому, для элементов третьего и высших периодов периодической системы Д. И. Менделеева правило октета может и не выполняться. Так, например, сера в соединении SF6 является шестиковалентной:
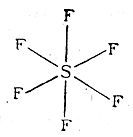
Об этом свидетельствует большая прочность SF6 по отношению кхимическим реагентам (не гидролизуется крепкой щелочью при нагревании). Шестиковалентен кремний в кремнефторидах типа Na2SiF6, восьмиковалентен осмий ввосьмифтористом осмии:
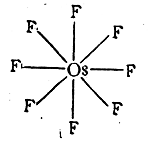
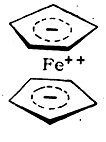
В молекуле дициклопентадиенилжелеза (ферроцена) все шесть π-электронов каждого циклопентадиенильного кольца (в виде аниона С5Н5- ) образуют с электронами на внутренних орбитах иона металла Fe++ приблизительно октаэдрически направленные координационные ковалентные связи;
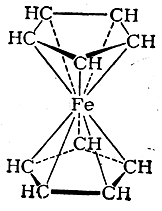
Вокруг атома железа создается устойчивая 36-электронная оболочка благородного газа (криптона), обусловливающая большую прочность соединения. Такие же связи существуют в молекулах всех циклопентадиенильных и бензольных производных других переходных металлов. Атомы металлов в молекулах этих веществ находятся в таком же состоянии, как атом железа в гексацианоферрат-ионе.
Указанные представления о природе связей в соединениях типа ферроцена (ценах) развиты в работах Э. О. Фишера. Другие авторы, подходящие к электронной структуре ферроцена на основе метода молекулярных орбит, считают, что в образовании связей с железом участвует лишь часть π-электронов циклопентадиенильных колец, и изображают структурную формулу ферроцена следующим образом: