Ферроцен
ФЕРРОЦЕН [бис(h|-циклопентадиенил)железо], оранжевые кристаллы; т. пл. 173 0C, т. кип. 249 0C; плотн. 1,49 г/см3 (25 0C); устойчив до 470 0C; возгоняется при атм. давлении; раств. в орг. р-рителях, не раств. в воде; устойчив к действию воздуха, горячей конц. водной HCl и 10%-ной водной NaOH.
В кристаллич. состоянии молекула ферроцена находится в заторможенной антипризматич. кон-формации; в газовой фазе может существовать в заслоненной конформации. Молекула непо-лярна, диамагнитна, связи Fe — С ковалентны. Ферроцен относится к небензоидным ароматич. си стемам. Для него характерны три типа хим. превращений: замещение водорода в С5Н5-кольцах без разрыва связей Fe — С, окисление по атому Fe и разрыв связи Fe-C. Р-ции электроф. замещения приводят к моно- и гетероаннулярным (содержащим заместители в разных циклах) дизамещ. ферроцена:

Дизамещенные ферроцена, содержащие заместитель в одном цикле (гомоаннулярные) и тризамещенные ферроцена, образуются в незна-чит. кол-ве. Таким образом протекают ацилирование, форми-лирование, алкилирование, сульфирование, аминометилиро-. вание, арилирование, металлирование. Р-ции электроф. замещения для ферроцена протекают легче, чем для бензола. Общее влияние заместителя на реакц. способность ферроцена аналогично влиянию в бензольном ряду. Ярко выраженных правил ориентации при вступлении второго заместителя в пяти-членное кольцо не обнаружено. Ферроценильная группа [Fe(C5H5)(C5H4)] во мн. р-циях переходит без изменения из соединения в соединение.
При взаимод. ферроцена с аренами в присут. AlCl3/Al одно кольцо замещается на арен и образуется катион [Fе(С5Н5)(арен)]+. Ферроцен легко и обратимо окисляется до катион-радикала фер-роцения (окислители: O2 воздуха в кислой среде, HNO3, FeCl3, I2, Ag+, Cu2+, H2O2, хиноны, N-бромсукцинимид, тетрациано-этилен и др.):

Окисление протекает без заметных изменений в геометрии ферроцена. Разбавленные р-ры солей ферроцения окрашены в синий цвет, концентрированные - в красный. Катион ферроцения образуется также при электрохим. окислении ферроцена и при действии на него галогенов и орг. пероксидов.
Связь Fe — С в ферроцене мало реакционноспособна; разрывается при действии очень сильных восстановителей: H2 в присут. Ni-Ренея (300 0C, 2,5 МПа) либо р-ров щелочных металлов в жидком NH3 или аминах.
Синтезируют ферроцен действием циклопентадиенида Na (Li, К, Tl) или циклопентадиенилмагнийбромида на галогениды Fe2+ либо из циклопентадиена и соед. Fe, напр.:
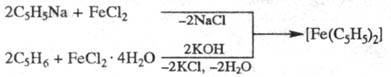
Возможно прямое образование ферроцена из Fe и C5H6 при 300 0C.
Ферроцен и его производные предложено использовать в качестве добавок, улучшающих эксплуатац. св-ва моторных масел и топлив. Полимеры на основе производных ферроцена высоко термически стабильны, обладают ценными электрич. и мага, св-ва-ми. Добавки ферроцена оказывают ингибирующее действие при тер-мо- и фотораспаде и окислении полимерных материалов. Нек-рые производные ферроцена используются как лекарства для лечения железодефицитной анемии (напр., натриевая соль о-карбоксибензоил ферроцена, или ферроцерон). Предложены светочувствит. материалы и композиции на основе ферроцена.
Впервые получен П. Посоном и др. (1951); его строение установлено P. Вудвордом и Дж. Уилкинсоном, что привело к бурному развитию химии металлоценов.
Лит.: Несмеянов A. H., Ферроцен и родственные соединения. Избранные труды, 1969-1979, M., 1982; Перевалова Э.Г., Решетова М.Д., Грандберг К.И., Методы элементоорганической химии. Железоорганиче-ские соединения. Ферроцен, M., 1983. Л. В. Рыбин.
