Олефины
ОЛЕФИНЫ (от лат. oleum-масло) (алкены, этиленовые углеводороды), ненасыщ. ациклич. углеводороды, содержащие одну двойную связь С=С; общая ф-ла СnН2n. Атомы углерода при двойной связи имеют sp2-гибридизацию и образуют s- и p-связи. Последняя состоит из двух базисных орбиталей-связывающей и разрыхляющей, образующихся за счет р-орбиталей атомов С. Энергия связи ~615 кДж/моль. Простейший олефин - этилен, валентные углы к-рого практически равны 120°. Для олефинов, начиная с С4Н8, наряду с изомерией углеродного скелета и разл. положения двойной связи, возможна геом. (цис-, транс-)изомерия, обусловленная большим барьером вращения вокруг двойной связи.
Названия олефинов образуются заменой окончания "ан" в назв. насыщ. углеводорода на "ен"; цифры перед назв. указывают положение двойной связи, напр. СН3СН=СНСН2СН3-2-пентен. Для низших членов гомологич. ряда сохранились назв. с окончанием "илен": этилен, пропилен и др.
В природе олефины встречаются редко. Один из немногих прир. олефинов-мускалур цис-9-трикозен) - феромон, выделяемый самками домашней мухи.
При нормальных условиях этилен, пропилен и бутены - газы, олефины состава С5-С18-бесцв. жидкости, высшие олефины-твердые в-ва. Олефины практически не раств. в воде, ограниченно раств. в спиртах и хорошо-в углеводородах, их галогенопроизвод-ных, простых и сложных эфирах.
ИК спектры олефинов сильно отличаются от спектров алканов и имеют характеристич. полосы при 1650 см-1 (валентные колебания связи С=С) и 3100, 1420, 915-1000 см-1 (колебания винильных С—Н-связей разл. типов). В спектрах ЯМР 1Н хим. сдвиги винильных протонов 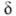 4,6-5,3 м. д. Для масс-спектров олефинов характерны фрагменты алкенильных ионов с т/z 41, 55, 69, 83, а также ионов с четным значением m/z 42, 56, 70.
4,6-5,3 м. д. Для масс-спектров олефинов характерны фрагменты алкенильных ионов с т/z 41, 55, 69, 83, а также ионов с четным значением m/z 42, 56, 70.
Олефины-высокореакционноспособные соединения. Наиб. характерны для них р-ции электроф. присоединения по двойной связи, протекающие, как правило, по бимолекулярному механизму через стадию образования карбкатиона или мос-тикового иона:
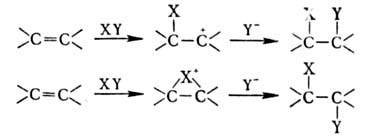
Присоединение электрофилов подчиняется Марковникова правилу. Наличие алкильных заместителей, стабилизирующих карбкатион, увеличивает реакц. способность олефинов.
Олефины легко присоединяют галогены с образованием вици-нальных дигалогенидов (F2 присоединяется при — 78 °С), константа равновесия р-ции иодирования очень мала. Для галогенов, особенно для Вг2, характерно анти-присоедине-ние, идущее через стадию образования мостикового иона.
В полярных средах галогеноводороды реагируют с олефинами с образованием алкилгалогенидов (см. Галогензамещенные углеводородов, Галогенирование, Гидрогалогенирование). Присоединение по двойной связи НСlO и НВгО приводит к хлор- и бромгидринам.
Важное пром. значение имеет гидратация олефинов, к-рая идет в присут. кислотных катализаторов, напр. H2SO4. Так, в пром-сти из этилена и пропилена получают этиловый и изопропиловый спирты.
В присут. АlСl3, BF3, HF и др. кислотных катализаторов олефины способны алкилировать насыщ. углеводороды; образующиеся алканы разветвленного строения применяют в качестве высокооктановых добавок к моторным топливам. В условиях р-ции Фриделя - Крафтса этилен алкилирует бензол до этилбензола-полупродукта при синтезе стирола. При алки-лировании бензола пропиленом образуется кумол, используемый для получения фенола и ацетона (см. Алкилирование).
Олефины вступают в р-ции электроф. присоединения со спиртами, к-тами, солями переходных металлов (Hg2 + , Tl3 + , Рb4 + ), NOCl, N2O3, N2O4, IN3 и др. Олефины вступают в р-цию гидроборирования: 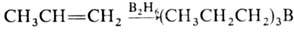 . Образующийся триалкилбор м. б. легко окислен Н2О2 в щелочной среде до соответствующего спирта. При взаимод. олефинов с формальдегидом образуются диолы или 1,3-диоксаны (Принса реакция), при гидроформилировании - альдегиды. В присут. кислотных катализаторов при повыш. т-ре происходит миграция двойной связи
. Образующийся триалкилбор м. б. легко окислен Н2О2 в щелочной среде до соответствующего спирта. При взаимод. олефинов с формальдегидом образуются диолы или 1,3-диоксаны (Принса реакция), при гидроформилировании - альдегиды. В присут. кислотных катализаторов при повыш. т-ре происходит миграция двойной связи 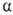 -олефинов в
-олефинов в 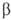 -положение, при этом возможна также изомеризация углеродного скелета. Протонные к-ты и к-ты Льюиса могут вызывать катионную полимеризацию олефинов. Этилен в этих условиях полимеризуется с трудом; пропилен и изобутилен в безводных средах образуют полимеры с очень длинными цепями. В присут. 60%-ной H2SO4 изобутилен димеризуется, гидрирование димера приводит к изооктану.
-положение, при этом возможна также изомеризация углеродного скелета. Протонные к-ты и к-ты Льюиса могут вызывать катионную полимеризацию олефинов. Этилен в этих условиях полимеризуется с трудом; пропилен и изобутилен в безводных средах образуют полимеры с очень длинными цепями. В присут. 60%-ной H2SO4 изобутилен димеризуется, гидрирование димера приводит к изооктану.
Для олефинов характерны также р-ции радикального присоединения по двойной связи. При взаимод. олефинов со своб. радикалом может идти полимеризация по цепному механизму (см. Цепные реакции, Радикальная полимеризация)или присоединение:
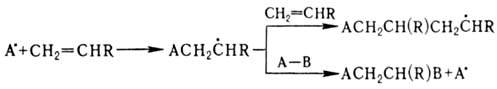
Соотношение между продуктами полимеризации и присоединения зависит от природы олефина и реагента, а также их концентрации. Полимеризация идет в том случае, если стадия переноса экзотермична, а олефин склонен к образованию устойчивых радикальных продуктов. В случае несимметричного олефина радикал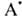 на первой стадии присоединяется к менее замещенному атому С. Этим объясняется радикальное присоединение НВг к олефинам в присут. пероксидов против правила Марковникова; аналогично присоединяются спирты, амины, ССl4, СВг4. Свободнорадикальная полимеризация этилена в пром-сти проводится при давлении 100 МГПа или более и т-ре выше 100°С, процесс инициируется пероксидами или О2 в следовых кол-вах. Пропилен и изобутилен по радикальному механизму полимеризуются плохо.
на первой стадии присоединяется к менее замещенному атому С. Этим объясняется радикальное присоединение НВг к олефинам в присут. пероксидов против правила Марковникова; аналогично присоединяются спирты, амины, ССl4, СВг4. Свободнорадикальная полимеризация этилена в пром-сти проводится при давлении 100 МГПа или более и т-ре выше 100°С, процесс инициируется пероксидами или О2 в следовых кол-вах. Пропилен и изобутилен по радикальному механизму полимеризуются плохо.
Р-ции нуклеоф. присоединения для олефинов менее характерны и идут лишь с сильными нуклеофилами, напр. с металлоорг. соед. типа бутиллития. К р-циям нуклеоф. присоединения м. б. отнесена также анионная полимеризация олефинов с применением катализаторов Циглера - Натты. В пром-сти таким способом получают высокомол. полиэтилен, стереорегуляр-ный изотактич. полипропилен и этилен-пропиленовый каучук.
Присоединение Н2 к олефинам на гетерог. катализаторах (метал-лич. мелкодисперсные Ni, Pt, Pd) приводит к соответствующим алканам (см. Гидрирование). Последние образуются также при р-ции олефинов с диимином.
Для олефинов характерны р-ции метатезиса и циклоприсоедине-ния. К последним относятся р-ции циклопропанирования карбенами, 1,3-диполярного циклоприсоединения и диеновый синтез.
При окислении олефинов в зависимости от условий р-ции образуются разл. продукты. В мягких условиях в слабощелочной среде КМnО4 окисляет олефины до гликолей (Вагнера реакция). Аналогично действует OsO4 в орг. р-рителях. В кислой среде окисление КМnО4 приводит к смеси кетонов и карбоновых к-т. В более жестких условиях при окислении йодной к-той в присут. OsO4 происходит расщепление молекулы олефинов по двойной связи с образованием смеси карбонильных соединений. Такие же продукты образуются после разложения озонидов при озонировании олефинов (см. Озонирование). Эти р-ции позволяют установить положение двойной связи в молекуле. В присут. Ag2O при 200-300 °С олефины взаимод. с О2 с образованием эпоксисоединсний, в пром-сти таким способом получают этилен- и пропиленоксиды. При действии на олефины надкислот (Прилежаева реакция)или Н2О2 в ацето-нитриле эпоксиды образуются количественно. При окислении этилена и пропилена кислородом воздуха в присут. СuСl2 и PdCl2 образуются соотв. ацетальдегид и ацетон.
Для олефинов характерны р-ции окисления по аллильному (соседнему с двойной связью) атому С. В пром-сти газофазным окислением пропилена получают акролеин, окислит. аммо-нолиз к-рого приводит к акрилонитрилу. При хлорировании при высоких т-рах (400-600 °С) образуются аллилхлориды. Аллильное замещение происходит также при взаимод. олефинов с N-бромсукцинимидом в ССl4 в присут. пероксидов (см. Воля - Циглера реакции). Эти р-ции идут по радикальному механизму.
Осн. пром. способы получения олефинов-процессы деструктивной переработки нефтепродуктов и прир. газа. Низшие олефины С2-С4 получают пиролизом прямогонного бензина, этана, пропана или газойля при 750-900 °С (см. Пиролиз нефтяного сырья); пропилен и бутен образуются при каталитич. крекинге вакуумного газойля. Газы пиролиза и крекинга разделяют дробной адсорбцией и низкотемпературной ректификацией под давлением. Разработаны методы получения этилена и пропилена из СН3ОН на цеолитных катализаторах. Линейные a-олефины С6-С20 получают термич. крекингом парафиновой фракции, содержащей нормальные алканы состава С14-С34 при 550 °С.
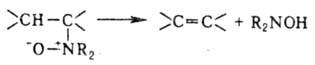
В лаб. условиях олефины получают дегидратацией спиртов над Аl2О3 и ThO2 при 400 °С или с помощью водоотнимающих агентов (H2SO4, P2O5); дегидрогалогенированием галогено-производных углеводородов (спиртовой р-р щелочи); де-галогенированием вицинальных дигалогеналканов [NaI в СН3ОН, Zn, соли Сг(Н) или Na2S2O3 в ДМСО]; разложением четвертичных аммониевых основании (см. Гофмана реакции); термич. разложением эфиров карбоновых к-т и ксанто-геновой к-ты (Чугаева реакция); восстановит. сочетанием альдегидов и кетонов при обработке LiAlH4 и TiCl3, напр. (СН3)2СО 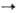 (СН3)2С=С(СН3)2; гидрированием ацетиленовых углеводородов или дегидрированием алканов; по Виттига реакции карбонильных соед. с алкилиденфосфоранами образуются селективно цис-олефины. Олефины могут быть получены наряду с N,N-дизамещенным гидроксиламином термич. разложением N-оксидов третичных аминов (Коупа реакция):
(СН3)2С=С(СН3)2; гидрированием ацетиленовых углеводородов или дегидрированием алканов; по Виттига реакции карбонильных соед. с алкилиденфосфоранами образуются селективно цис-олефины. Олефины могут быть получены наряду с N,N-дизамещенным гидроксиламином термич. разложением N-оксидов третичных аминов (Коупа реакция):
Качеств. определение олефинов проводят по обесцвечиванию р-ра Вг2 в ССl4 или по р-ции Вагнера, количественное - бро-мированием смесью КВгО3 и КВг в присут. H2SO4 с послед. добавлением избытка KI и оттитровыванием выделившегося иода Na2S2O3.
Олефины-осн. исходные реагенты в хим. пром-сти. Из этилена и пропилена получают разл. полимеры и эластомеры, эпоксисоединения, дихлорэтан, винилхлорид, этанол, изо-пропанол, стирол и т.д. Изобутилен - сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики. a-Олефины состава С10-С18 применяют при синтезе ПАВ (алкилбензолсульфонаты, олефинсульфонаты, алкилсульфо-наты), а также для получения высших спиртов. См. также Гексен, Пентены.
Мировой объем произ-ва олефинов ок. 70 млн. т (1985).
Лит.: Роберте Д. Д., Касерио М. К., Основы органической химии, пер. с англ., т. 1, М., 1978; Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 169-232. А. А. Братков.
