Аллилхлорид
АЛЛИЛХЛОРИД (хлористый аллил, З-хлор-1-пропен) СН2=СНСН2С1, мол. м. 76,53; бесцв. жидкость с резким запахом; т. пл. - 134,5°С, т. кип. 44,96°С; d420 0,937, плоти, по воздуху 2,64; пD20 1,4157; г, (мПа*с) 0,158 (-20°С), 0,330 (20°С), 0,177 (100°С);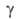 (мН/м) 23,0 (20°С), 15,8 (80°С); давление пара (кПа) 1,61 (-40°С), 16,80 (0°С), 40,52 (20°С), 123 (50°С); tкрит 240,7°С, pкрит4,66 МПа, dкрит0,327 г/см3; С°р[кДж/(кг-К)] 1,495 (-40°С), 1,662 (20°С), 1,968 (100°С), для пара 0,829 (-50°С), 1,059 (50°С), 1,164 (100°С); теплопроводность [Вт/(м*К)] 0,145 (20°С), 0,113 (100°С);
(мН/м) 23,0 (20°С), 15,8 (80°С); давление пара (кПа) 1,61 (-40°С), 16,80 (0°С), 40,52 (20°С), 123 (50°С); tкрит 240,7°С, pкрит4,66 МПа, dкрит0,327 г/см3; С°р[кДж/(кг-К)] 1,495 (-40°С), 1,662 (20°С), 1,968 (100°С), для пара 0,829 (-50°С), 1,059 (50°С), 1,164 (100°С); теплопроводность [Вт/(м*К)] 0,145 (20°С), 0,113 (100°С);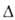 Н°исп 372,2 кДж/кг (20°С), 313,2 кДж/кг (100°С),
Н°исп 372,2 кДж/кг (20°С), 313,2 кДж/кг (100°С),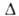 Н°сгор - 1849,82 кДж/моль,
Н°сгор - 1849,82 кДж/моль, Нобр - 0,63 кДж/моль;
Нобр - 0,63 кДж/моль;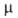 6,6*10-30 Кл*м (пар);
6,6*10-30 Кл*м (пар);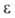 8,7 (1 °С), для пара 1,013 (19°С). Хорошо раств. в обычных орг. р-рителях. Р-римость в воде 0,36% (20°С), воды в аллилхлориде 0,08% (20 °С). Образует азеотропную смесь с водой (2,2% Н2О; т. кип. 43,0°С). Энергия связи С—С1 252,71 кДж/моль, длина связи С—С1 0,1825 нм.
8,7 (1 °С), для пара 1,013 (19°С). Хорошо раств. в обычных орг. р-рителях. Р-римость в воде 0,36% (20°С), воды в аллилхлориде 0,08% (20 °С). Образует азеотропную смесь с водой (2,2% Н2О; т. кип. 43,0°С). Энергия связи С—С1 252,71 кДж/моль, длина связи С—С1 0,1825 нм.
По двойной связи аллилхлорид вступает в р-ции, типичные для ненасыщ. соединений. Хлор в аллилхлориде подвижен и может легко замещаться, напр. на ОН или NH2 с образованием соотв. аллилового спирта и аллиламина. При т-ре кипения в присут. пероксидов аллилхлорид способен полимеризоваться. Легко образует простые и сложные эфиры.
Получают аллилхлорид хлорированием пропилена при 500 °С; соотношение пропилен: хлор = 5:1; выход 80% по хлору. Применяют аллилхлорид гл. обр. для произ-ва эпихлоргидрина, глицери-на, аллилового спирта, а также разл. аллиловых эфиров, аллиламина, циклопропана, аллилсахарозы и др.
Т. всп. — 29 °С, т. самовоспл. 420 °С, температурные пределы воспламенения от -29°С до 0°С; КПВ 3,0-14,8%. ПДК 0,3 мг/м3, в водоемах-0,3 мг/л. Мировое произ-во 180 тыс. т/год (1977).
Литература
Промышленные хлорорганические продукты. Справочник, под ред. Л.А. Ошина, М., 1978. См. также лит. при ст. Галогензамещенные углеводородов. Ю.А. Трегер.
