Циклопропан
ЦИКЛОПРОПАН (триметилен), мол. м. 42,08; бесцв. газ, т. пл. -127 °С, т. кип. -33 °С;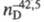 1,3799,
1,3799,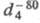 0,7352; раств. в орг. р-рителях, плохо - в воде; легко воспламеняется; смеси с воздухом, О2 и N2O взрывоопасны.
0,7352; раств. в орг. р-рителях, плохо - в воде; легко воспламеняется; смеси с воздухом, О2 и N2O взрывоопасны.

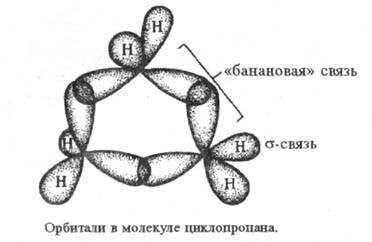
Циклопропан - простейший циклоалкан, трехчленный цикл к-рого обладает значит. энергией напряжения (~ 115 кДж/моль) и повышенной по сравнению с др. циклоалканами хим. активностью. Углы в циклопропане 60° (ССС), 114-115° (НСН), длины связей 0,151 (С —С) и 0,109 нм (С —Н). Малая величина угла ССС по сравнению с углом между sр3-гибридизованными орбиталями (109,5°) позволяет предположить, что при образовании связей С — С в циклопропане не достигается макс. перекрывание атомных орбиталей. Такие связи наз. "банановыми" (рис.), по своему характеру они являются промежуточными между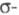 и
и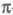 -связями, поэтому циклопропан может вести себя подобно олефинам. Кроме того, благодаря слабости "банановой" связи, циклопропан легко раскрывает кольцо в разл. р-циях. Возможны др. способы описания характера и св-в связей в циклопропане.
-связями, поэтому циклопропан может вести себя подобно олефинам. Кроме того, благодаря слабости "банановой" связи, циклопропан легко раскрывает кольцо в разл. р-циях. Возможны др. способы описания характера и св-в связей в циклопропане.
Замещение в циклопропане значительно изменяет его геометрию. Так, электронодонорные заместители укорачивают прилежащие связи С — С и удлиняют противолежащую; электроноакцепторные группы действуют наоборот; объемные вицинальные заместители удлиняют связь между атомами С, несущими эти заместители. В высоконапряженных структурах при сочленении циклопропана с др. циклами, в т. ч. циклопропановыми, наблюдаются большие искажения 3-членного цикла (см. Напряжение молекул).
Циклопропан- слабая СН-к-та: рКа46 (вода, 25 °С).
Легко протекает изомеризация циклопропана в пропен; р-ция осуществляется термически или в присут. каталитич. кол-в Pt, Pd, Fe, Ni, Rh, A12O3.
При действии Н2 алкилциклопропаны в мягких условиях подвергаются гидрогенолизу либо изомеризации с послед. гидрированием:
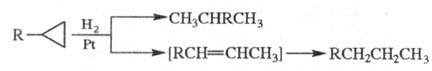
Р-ция циклопропана с протонными к-тами приводит к пропилгалогенидам. В присут. А1С13 циклопропан алкилирует ароматич. соед. с образованием как пропильных, так и изопропильных производных; при этом при переходе от n-ксилола к о-дихлорбензолу соотношение указанных изомеров изменяется от (92 : 8) до (4 : 96) соотв.
С хлором и бромом циклопропан реагирует неодинаково. В условиях радикального бромирования образуется 1,3-дибромпропан, а радикального хлорирования в мягких условиях - 1,1-дихлорциклопропан. При электроф. бромировании получают смесь бромпропанов:
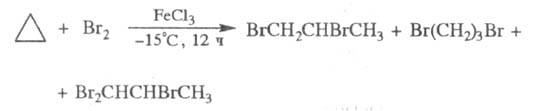
Р-ция циклопропана и его производных с солями ртути в среде протонных р-рителей приводит к -меркурир. спиртам [или их алкокси(ацилокси)производным]; р-ция не имеет аналогов в химии др. карбоциклов:
-меркурир. спиртам [или их алкокси(ацилокси)производным]; р-ция не имеет аналогов в химии др. карбоциклов:
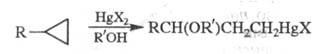
R'=H,Alk, Ас
Замещенные циклопропана, содержащие электронодонорные и электроноакцепторные группы, при умеренном нагревании претерпевают гетеролиз по наиб. замещенной связи, напр.:
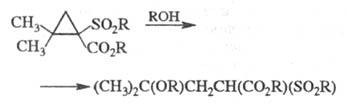
1,1-Дигалогенциклопропаны при действии (C4H9)3SnH или Mg в СН3ОН восстанавливаются в моногалогениды, а при взаимод. с CH3Li превращаются в соответствующие аллены:
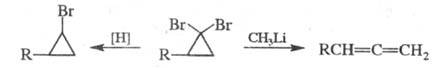
Циклопропан и его производные получают действием Zn-пыли на 1,3-дигалогениды:
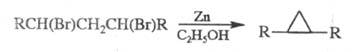
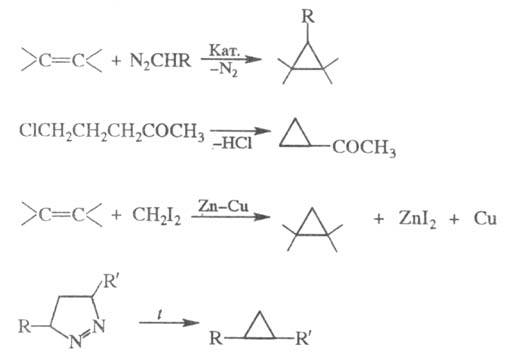
Для синтеза функционально замещенных циклопропана используют р-ции внедрения по связи С = С при действии диазоэфиров (кат.- комплексы Сu и Rh) или диазометана, генерируемого в присут. комплексов Pd; элиминирование HHal из галогензамещенных кетонов, эфиров или нитрилов; взаимод. олефинов с СН2I2 в присут. пары Zn - Сu (см. Симмонса-Смита реакция); термич. разложение пиразолинов:
галогензамещенных кетонов, эфиров или нитрилов; взаимод. олефинов с СН2I2 в присут. пары Zn - Сu (см. Симмонса-Смита реакция); термич. разложение пиразолинов:
Галогенциклопропаны получают внедрением галогенкарбенов в олефины.
Циклопропан и его фторпроизводные применяют в медицине как средства для ингаляц. наркоза. Эфиры циклопропанкарбоновой к-ты - средства защиты растений (см. Пиретроиды).
Лит.: Яновская Л. А., Домбр овский В. А., Хусид А. X., Циклопропаны с функциональными группами, М., 1980; Иоффе А.И., Святкин В.А., Нефедов О. М., Строение производных циклопропана, М., 1986; Houben-Weyl, Metoden der organischen Chemie, 4 Aufl., Bd 13, Tl 2a, Stuttg., 1973.
Ю. В. Томилов.
