Гемоглобин
Главная функция эритроцитов — транспорт кислорода от легких в ткани и СО2 от тканей обратно в легкие. Высшие организмы нуждаются для этого в специальной транспортной системе, так как молекулярный кислород плохо растворим в воде: в 1 л плазмы крови растворимо только около 3,2 мл О2. Содержащийся в эритроцитах белок гемоглобин (Hb) способен связать в 70 раз больше — 220 мл О2/л. Содержание Hb в крови составляет 140-180 г/л у мужчин и 120-160 г/л у женщин, т. е. вдвое выше по сравнению с белками плазмы (50-80 г/л). Поэтому Hb вносит наибольший вклад в образование рН-буферной емкости крови.
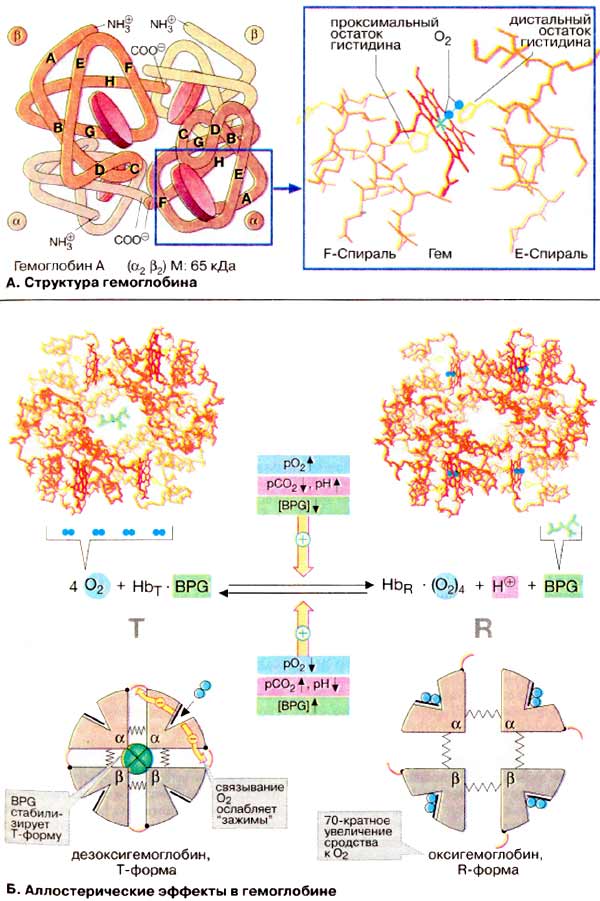
А. Структура гемоглобина
Гемоглобин взрослого организма (HbA, см. ниже) является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами примерно 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию. Примерно 80% аминокислотных остатков глобина образуют α-спирали, обозначенные буквами А-Н. Каждая субъединица несет группу гема (формулу см. на рис. 197) с ионом двухвалентного железа в центре. При связывании O2 с атомом железа в геме (оксигенация Hb) и отщеплении O2 (дезоксигенация) степень окисления атома железа не меняется. Окисление Fe2+ до Fe3+ в геме носит случайный характер. Окисленная форма гемоглобина, метгемоглобин, не способна переносить O2. Доля метгемоглобина поддерживается ферментами на низком уровне и составляет поэтому обычно только 1-2%.
Четыре из шести координационных связей атома железа в гемоглобине заняты атомами азота пиррольных колец, пятая — остатком гистидина глобина (проксимальный остаток гистидина), а шестая — молекулой кислорода в оксигемоглобине и, соответственно, Н2О в дезоксигемоглобине.
Б. Аллостерические эффекты в гемоглобине
Аналогично аспартат-карбамоилтрансферазе Hb может находиться в двух состояниях (конформациях): обозначаемых как Т- и R-формы соответственно. Т-Форма (напряженная от англ. tense) обладает существенно более низким сродством к O2 по сравнению с R-формой (на схеме справа). Связывание O2 с одной из субъединиц Т-формы приводит к локальным конформационным изменениям, которые ослабляют связь между субъединицами. С возрастанием парциального давления O2 увеличивается доля молекул Hb в высокоаффинной R-форме (от англ. relaxed). Благодаря кооперативным взаимодействиям между субъединицами с ростом концентрации кислорода повышается сродство Hb к O2, в результате чего кривая насыщения имеет сигмоидальный вид (см. с 276).
На равновесие между Т- и R-формами влияют различные аллостерические эффекторы, регулирующие связывание O2 гемоглобином (желтые стрелки). К наиболее важным эффекторам относятся CO2, Н+ и 2,3-дифосфоглицерат [ДФГ (BPG)].
Дополнительная информация
Hb взрослого организма состоит, как упомянуто выше, из двух α- и двух β-цепей (α2β2). Наряду с этой основной формой (HbA1) в крови присутствуют незначительные количества второй формы с более высоким сродством к O2, у второй β-цепи заменены δ-цепя-ми (HbA2, α2δ2). Две другие формы Hb встречаются только в эмбриональном периоде развития. В первые три месяца образуются эмбриональные гемоглобины состава ξ2ε2 и α2γ2. Затем вплоть до рождения доминирует фетальный гемоглобин (HbF, α2δ2), который постепенно заменяется на первом месяце жизни на HbА. Эмбриональный и фетальный гемоглобины обладают более высоким сродством к О2 по сравнению с HbА, так как они должны переносить кислород из системы материнского кровообращения.


