Транспорт газов
Большинство тканей для поддержания своего окислительного потенциала постоянно снабжаются молекулярным кислородом (O2). Из-за плохой растворимости O2 связывается и транспортируется в крови гемоглобином. Свойства Hb таковы, что он не только обеспечивает транспорт кислорода, но и создает благоприятные условия для связывания O2 в легких и передачи его тканям.
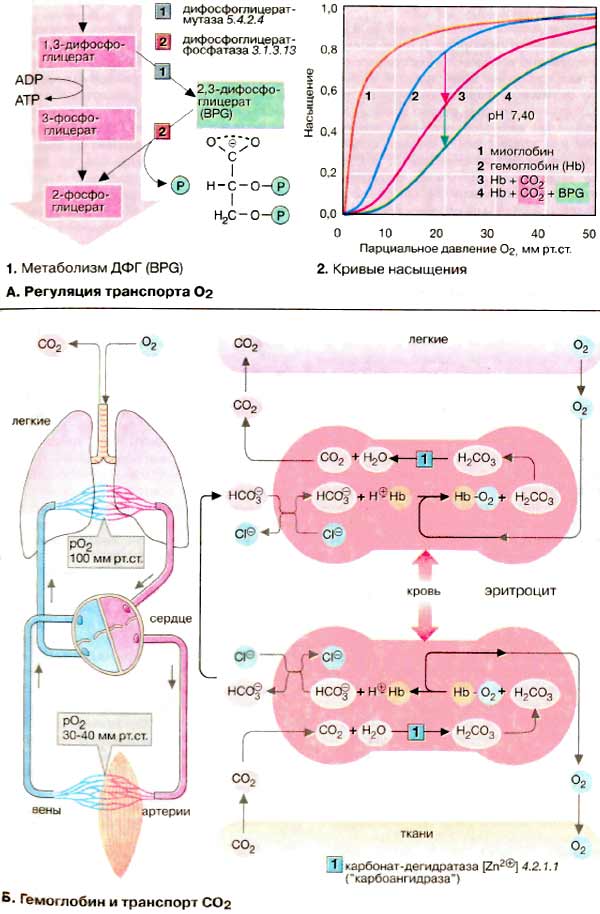
А. Регуляция транспорта O2
ЕСЛИ фермент реагирует на эффекторы (субстрат, активатор или ингибитор) повышением или понижением активности благодаря конформационным изменениям, то в этом случае говорят об аллостерической регуляции. Аллостерические ферменты являются, как правило, олигомерами, состоящими из нескольких субъединиц, которые взаимно влияют друг на друга.
Хотя гемоглобин не является ферментом (он связывает и отдает кислород неизмененным), он имеет все признаки аллостерического белка. Его эффектором служит кислород, который как положительный гомотропный эффектор с повышением концентрации увеличивает константу связывания. Кривая насыщения гемоглобина O2 имеет ярко выраженный сигмоидальный характер (2, кривая 2). Для сравнения приведена несигмоидальная кривая насыщения мышечного белка миоглобина (2, кривая 1). Миоглобин похож по структуре на гемоглобины, но, являясь мономером, не обнаруживает аллостерических свойств.
В качестве гетеротропных эффекторов гемоглобинов выступают СO2 и Н+-ионы и в особенности метаболит эритроцитов 2,3-дифосфоглицерат [ДФГ (BPG)]. ДФГ синтезируется из 1,3-дифосфоглицерата (1), промежуточного продукта гликолиза. ДФГ может снова участвовать в гликолизе, превращаясь в 2-фосфоглицерат, при этом напрасно пропадает АТФ. ДФГ избирательно связывается с дезокси-Hb и увеличивает вследствие этого его равновесную долю в паре Hb/дезокси-Hb. Результатом является повышенное высвобождение O2 при постоянстве рO2. На диаграмме это соответствует смещению кривой насыщения вправо (2, кривая 3). Аналогично ДФГ действуют CO2 и H+-ионы. Такое влияние на положение кривой долгое время было известно под названием эффект Бора. Действия СO2 и ДФГ являются аддитивными. В присутствии обоих эффекторов кривая насыщения изолированного Hb похожа на кривую, полученную для нативной крови (2, кривая 4).
Б. Гемоглобин и транспорт СO2
Гемоглобин участвует также в транспорте диоксида углерода (СO2) от тканей к легким. Примерно 5% образующегося в тканях СO2 ковалентно связываются с N-концом гемоглобина и транспортируется как карбамино-Hb (не показано). Около 90% СO2 превращается в более растворимый гидрокарбонат (HCO3-) (на схеме внизу). В легких (на схеме вверху) из него снова регенерируется СO2, который выводится легкими.
Оба процесса сопряжены с дезоксигенированием и соответственно оксигенированием Hb. Дезокси-Hb — более сильное основание, чем окси-Hb. Он связывает дополнительные протоны (примерно 0,7 H+ на тетрамер) и вследствие этого содействует образованию в своем микроокружении HCO3-из СO2. На мембране эритроцитов HCO3-посредством антипорта обменивается с Cl-и в составе плазмы поступает в легкие, где эти реакции протекают в обратном направлении. Дезокси-Hb оксигенируется и освобождает протоны, которые сдвигают равновесие HCO3-/СO2 влево и тем самым содействуют выделению СO2.
По тому же механизму происходит соединение O2 с Hb, регулируемое Н+-ионами (рН-зависимость). Высокая концентрация СO2, существующая в тканях с интенсивным обменом веществ, увеличивает локальную концентрацию Н+ и снижает сродство гемоглобина к O2 (эффект Бора, см. выше). Это ведет к усиленному освобождению O2 и вместе с тем к лучшему снабжению кислородом.
Без катализатора равновесие между СO2 и HCO3- устанавливается относительно медленно. В эритроцитах эта реакция ускоряется карбонат-дегидратазой («карбоангидразой»), присутствующий в достаточно высокой концентрации.


