Миоглобин
МИОГЛОБИН (от греч. mys, род. падеж myos- мышца и лат. globus-шар), белок мышц позвоночных животных и человека, связывающий переносимый гемоглобином О2 и передающий его окислит. системам клетки.
Состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в плотную глобулу размером 4,5 х 2,5 нм. В спец. полости миоглобина ("кармане") помещается гем, к-рый связан с остальной частью молекулы (глобином), как в гемоглобине. Ок. 75% полипептидной цепи находится в конформации a-спирали (все a-спирали правозакрученные). Между областями спи-рализации находятся 5 неспирализованных участков; такие же участки находятся на концах цепи. Внутр. область молекулы состоит гл. обр. из неполярных остатков лейцина, валина, метионина, фенилаланина и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина, аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как полярные, так и неполярные аминокислотные остатки.
Атом железа гема может находиться в 4 состояниях: в физиологически активном пентакоординир. высокоспиновом ферросостоянии (дезоксимиоглобин, Fe2 + , спиновое число 2), в гексакоординир. высокоспиновом феррисостоя-нии (метмиоглобин, Fe3 + , 6-й лиганд Н2О, спиновое число 5/2) и в низкоспиновых ферро- и феррисостояниях (соотв. Fe2+ и Fe3+ , спиновое число О и 1/2). Низкоспиновые формы образуются из высокоспиновых при взаимод. атома железа гема с нек-рыми лигандами (у дезоксимиоглобина с О2, СО, NO и др.; у метмиоглобина с CN-, N-3 и ими-дазолом). Для феррисостояния возможна смесь высокоспиновой и низкоспиновой форм (лиганды ОН-, NO-2, NCS-).
Связывание лигандов сопровождается конформац. изменениями белка, и, наоборот, конформац. изменения вблизи гема изменяют его электронное состояние и реакц. способность (т.наз. электронно-конформац. взаимод.). Ф-ция миоглобина запасать О2 в мышцах при его избытке и освобождать при недостатке основана на способности иона Fe2+ обратимо связывать молекулу О2 с образованием оксимио-глобина.
Высвобождение из оксимиоглобина молекулы О2, необходимого работающей мышце, происходит в момент сокращения последней, когда в результате сжатия капилляров парциальное давление О2 резко падает. Белок выполняет роль водорастворимого носителя гема, предохраняет Fe2+ от окисления при его взаимод. с О2 и регулирует величину сродства к О2. При одном и том же геме и способе его связывания с белком константа равновесия р-ции оксимио-глобин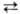 дезоксимиоглобин + О2 для миоглобина из разных организмов изменяется в пределах от 0,2.106 до 2,2.106 М-1 (давление О2, соответствующее полунасыщению, от 2,7 до 0,5 мм рт. ст.). Метмиоглобин обладает также слабыми пероксидазной и каталазной активностями.
дезоксимиоглобин + О2 для миоглобина из разных организмов изменяется в пределах от 0,2.106 до 2,2.106 М-1 (давление О2, соответствующее полунасыщению, от 2,7 до 0,5 мм рт. ст.). Метмиоглобин обладает также слабыми пероксидазной и каталазной активностями.
В больших кол-вах миоглобин содержится в мышцах морских млекопитающих-дельфинов и тюленей (соотв. 3,5 и 7,7% от массы тела).
Миоглобин кашалота был первым белком, для к-рого Дж. Кендрю с сотрудниками в 1957-60 определили пространств. структуру молекулы методом рентгеноструктурного анализа.
Исп. литература для статьи «МИОГЛОБИН»: Страйер Л., Биохимия, пер. с англ., т. 1, М., 1984, с. 48-67; Kendrew J., Dickerson R., Strandberg В., "Nature", 1960, v. 185, p. 422-27; Antonini E., Brunori M., Hemoglobin and myoglobin in their reactions with ligands, Amst.-L., 1971; Perutz M., "British Medical Bulletin", 1976, v. 32, № 3, p. 195-208. Ю. А. Шаронов.
