Фенилаланин
ФЕНИЛАЛАНИН (2-амино-З-фенилпропионовая к-та, b-фенил-a-аланин, Phe, F), мол. м. 165,19; бесцв. кристаллы, т. пл. D, L-, D- и L-фенилаланин соотв. 271-273, 285 и 283 0C (все плавятся с разложением); сублимируется в вакууме; для D-фенилаланина 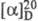 +7,1° (концентрация 3,8 г в 100 мл 18% HCl), для L-фенилаланина
+7,1° (концентрация 3,8 г в 100 мл 18% HCl), для L-фенилаланина 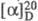 -35,1° (концентрация 1,94 г в 100 мл воды); ограниченно раств. в воде, плохо - в этаноле. При 25 0C рКа 2,58 (COOH) и 9,24 (NH2); рI 5,91. D-Фенилаланин имеет сладкий вкус, L-фенилаланин - слегка горьковатый.
-35,1° (концентрация 1,94 г в 100 мл воды); ограниченно раств. в воде, плохо - в этаноле. При 25 0C рКа 2,58 (COOH) и 9,24 (NH2); рI 5,91. D-Фенилаланин имеет сладкий вкус, L-фенилаланин - слегка горьковатый.
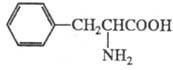
Фенилаланин- ароматич. 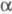 -аминокислота, дает ксантопротеиновую реакиию, м. б. осажден из водного р-ра 2,5-дибромбензол-сульфокислотой. При нагревании фенилаланин декарбоксилируется с образованием 2-фенилэтиламина; нитрованием фенилаланина может быть получен 4-нитрофенилаланин.
-аминокислота, дает ксантопротеиновую реакиию, м. б. осажден из водного р-ра 2,5-дибромбензол-сульфокислотой. При нагревании фенилаланин декарбоксилируется с образованием 2-фенилэтиламина; нитрованием фенилаланина может быть получен 4-нитрофенилаланин.
L-Фенилаланин - кодируемая, незаменимая аминокислота, встречается во всех организмах в составе молекул белков, напр, в оваль-бумине, зеине, фибрине, инсулине, гемоглобине; входит в состав пептидов-подсластителей (см. Аспартам), соматоста-тина и энкефалина. Остаток D-фенилаланина входит в грамицидин S и нек-рые др. пептиды.
Биосинтез L-фенилаланина осуществляется из эритрозо-4-фосфата и фосфоенолпирувата через шикимовую, префеновую (см. Обмен веществ)и фенилпировиноградную к-ты.
В организме под действием фермента фенилаланин - 4-мо-нооксигеназы фенилаланин превращается в тирозин. При отсутствии или резком снижении активности фермента возникает заболевание фенилкетонурия, к-рое проявляется гл. обр. выраженной олигофренией.
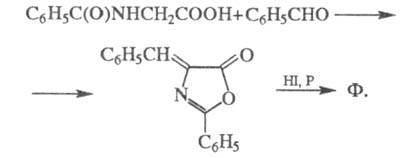
Синтезируют фенилаланин из малонового эфира и бензилхлорида, а также из гиппуровой к-ты и бензальдегида через азлактон:
В УФ спектре фенилаланина 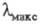 257,4 нм,
257,4 нм, 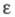 1,97·102, в спектре флуоресценции фенилаланина
1,97·102, в спектре флуоресценции фенилаланина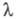 испускания 282 нм. В спектре ПМР L-фенилаланина в D2O величины хим. сдвигов протонов (в м.д.) у
испускания 282 нм. В спектре ПМР L-фенилаланина в D2O величины хим. сдвигов протонов (в м.д.) у 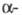 и
и 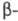 атомов С цепи соотв. 3,993 и 3,292, 3,127.
атомов С цепи соотв. 3,993 и 3,292, 3,127.
L-Фенилаланин впервые выделили из ростков люпина Э. Шульце и И. Барбиери в 1881.
Мировое произ-во L-фенилаланина ок. 150 т в год (1982). В. В. Боев.
