Углерода диоксид
УГЛЕРОДА ДИОКСИД (углекислый газ, угольный ангидрид) CO2, мол. м. 44,01; бесцв. газ с кисловатым запахом и вкусом. Молекула CO2 имеет линейную конфигурацию, длина связи С — О в своб. молекуле 0,113 нм, в твердом углерода диоксиде 0,105 HM. Тройная точка: -56,6 0C, 0,52 МПа; tкрит 31,3 0C, pкрит7,36 МПа; т.возг. -78,5 0C (0,1 МПа). Для газа: плотн. 1,9768 г/л (0 0C, 0,1 МПа); 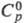 34,57 Дж/(моль·К);
34,57 Дж/(моль·К);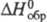 -393,51 кДж/моль;
-393,51 кДж/моль; 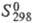 213,67 Дж/(моль·К);
213,67 Дж/(моль·К);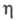 1,39· 10-5 Па·с (0 0C, 1 МПа).
1,39· 10-5 Па·с (0 0C, 1 МПа).
При 20 0C и давлении 5,7 МПа углерода диоксид сжижается в бесцв. жидкость; плотн. 0,925 кг/дм3 (0 0C, 3,554 МПа); 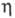 8,5·I0-5 Па·с (10 0C, 5,7 МПа);
8,5·I0-5 Па·с (10 0C, 5,7 МПа); 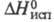 5,27 кДж/моль (6,34 МПа). При нормальном давлении и т-ре -78,5 0C углерода диоксид кристаллизуется в белую снегоподобную массу; кристаллич. решетка кубич. гранецентрированная (а = 0,563 нм, z = 4, пространств, группа Pa3); плотн. 1,56 г/см3 (-78,5 0C).
5,27 кДж/моль (6,34 МПа). При нормальном давлении и т-ре -78,5 0C углерода диоксид кристаллизуется в белую снегоподобную массу; кристаллич. решетка кубич. гранецентрированная (а = 0,563 нм, z = 4, пространств, группа Pa3); плотн. 1,56 г/см3 (-78,5 0C).
Углерода диоксид термически весьма устойчив; диссоциация 2CO2 2CO + O2 начинается ок. 1200 0C; при 2600 0C распадается ок. 50%, а при 2800 0C - ок. 75% CO2. Р-римость CO2 в воде при нормальном давлении, мл в 100 мл: 171 (0 0C), 102 (15 0C), 66 (30 0C), 36 (60 0C). В коллоидных водных р-рах орг. B-B р-римость CO2 значительно выше из-за его адсорбции на коллоидных частицах: Жидкий углерода диоксид хорошо раств. в эфире и низших спиртах, но почти не растворяет к.-л. твердые в-ва. С водой углерода диоксид образует угольную кислоту.
2CO + O2 начинается ок. 1200 0C; при 2600 0C распадается ок. 50%, а при 2800 0C - ок. 75% CO2. Р-римость CO2 в воде при нормальном давлении, мл в 100 мл: 171 (0 0C), 102 (15 0C), 66 (30 0C), 36 (60 0C). В коллоидных водных р-рах орг. B-B р-римость CO2 значительно выше из-за его адсорбции на коллоидных частицах: Жидкий углерода диоксид хорошо раств. в эфире и низших спиртах, но почти не растворяет к.-л. твердые в-ва. С водой углерода диоксид образует угольную кислоту.
Углерода диоксид обладает св-вами кислотных оксидов, взаимод. с оксидами и гидроксидами щелочных и щел.-зем. металлов, давая карбонаты. При высокой т-ре CO2 окисляет сильно электро-положит. металлы (К, Mg, Zn и др.), напр.: 2Mg + CO2 2MgO + С. При пропускании CO2 над раскаленным углем образуется углерода оксид (р-ция Будуара): CO2 + С
2MgO + С. При пропускании CO2 над раскаленным углем образуется углерода оксид (р-ция Будуара): CO2 + С  2CO, эта р-ция очень важна в металлургии. О р-циях с орг. в-вами см. Карбоксилирование.
2CO, эта р-ция очень важна в металлургии. О р-циях с орг. в-вами см. Карбоксилирование.
В технике углерода диоксид получают при горении углерода и орг. B-B, как побочный продукт при обжиге известняка (образующийся при этом CO2 сильно загрязнен азотом), выделением из коксового газа, а также из дымовых газов обычных котельных установок. Пром. значение имеет также углерода диоксид, образующийся при спиртовом брожении. В нек-рых местностях для добычи CO2 используют прир. источники газа и сильно минерализованные воды, пересыщенные углерода диоксидом. В лабораториях углерода диоксид получают разложением CaCO3, NaHCO3 или Na2CO3 соляной либо серной к-той. Для произ-ва жидкого углерода диоксида используют газ с содержанием CO2 выше 95%. После сжатия и охлаждения жидкий CO2 разливают в стальные баллоны серого цвета. Твердый углерода диоксид ("сухой лед") получают частичным испарением жидкого CO2.
Углерода диоксид содержится в атмосфере (0,03% по объему), морской воде (ок. 90 г в 1 м3), водах минер. источников (особенно вблизи вулканов), литосфере в форме минералов - карбонатов (кальцит, доломит и др.). Углерода диоксид образуется при горении и гниении орг. B-B, сжигании топлива, при дыхании животных и человека, ассимилируется растениями, играя важную роль в фотосинтезе.
Углерода диоксид используют в пищ. пром-сти в произ-ве сахара, пива, газированных вод, шипучих вин, в медицине для приготовления углекислых ванн, для тушения пожаров, в качестве нагнетающего газа для перекачки огнеопасных жидкостей, для консервации пищ. продуктов (CO2 не поддерживает жизнедеятельность бактерий и плесеней), обогащения воздуха в теплицах (способствует росту растений и повышению урожайности), как пропеллент в бытовой химии. Твердый углерода диоксид-хладагент, к-рый дает больший охлаждающий эффект, чем водяной лед, испаряется без остатка и не вызывает коррозии оборудования. Углерода диоксид применяют для произ-ва мочевины [CO2+ 2NH3 H2COONH4
H2COONH4  CO(NH2)2 + H2O], соды по методу Сольвэ (NaCl + NH3 + CO2 + H2O
CO(NH2)2 + H2O], соды по методу Сольвэ (NaCl + NH3 + CO2 + H2O
 NaHCO3 + NH4Cl), метанола (CO2 + 3H2
NaHCO3 + NH4Cl), метанола (CO2 + 3H2
 CH3OH + H2O), гидроксикарбоновых к-т (напр., салициловой), для очистки рассолов NaCl.
CH3OH + H2O), гидроксикарбоновых к-т (напр., салициловой), для очистки рассолов NaCl.
При концентрации углерода диоксида в воздухе 0,25-1% у человека изменяется ф-ция дыхания и кровообращения, при 2,5-5% наблюдается головная боль, раздражение верх, дыхат. путей и др., при 7% учащается сердцебиение, появляются рвота, головокружение и др. При высоких концентрациях углерода диоксида в воздухе наступает смерть от остановки дыхания (при 20% через неск. секунд). Отравления углерода диоксидом возможны при очистке бродильных чанов и цистерн для хранения вина, винных бочек, на складах зерна, в овощехранилищах и силосных башнях, в погребах с гнилым и проросшим картофелем (вплоть до смертельного исхода), при очистке канализац. и водопроводных труб, при работе с сухим льдом и др.
Я. А. Калашников.
