Тиофен
ТИОФЕН, мол. м. 84,14; бесцв. жидкость с запахом бензола; т. пл. -38,2°С, т. кип. 84,2 °С; 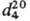 1,0649,
1,0649, 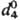 1,0873;
1,0873; 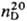 1,5289; tкрит 307,2°С; tкрит 5,69 МПа; m1,766·10-30 Кл·м; Сp 63,8 ДжДмоль · К);
1,5289; tкрит 307,2°С; tкрит 5,69 МПа; m1,766·10-30 Кл·м; Сp 63,8 ДжДмоль · К); 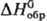 - 82,13 кДж/моль, DHисп 33,483 кДж/моль,
- 82,13 кДж/моль, DHисп 33,483 кДж/моль, 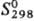 277 Дж/(моль·К).
277 Дж/(моль·К).
Хорошо раств. в углеводородах и др. орг. р-ри-телях, не раств. в воде. Молекула тиофена плоская.
Гомологи тиофена- бесцв. жидкости, р-римые во мн. орг. р-рителях. Для 2-метилтиофена т. пл. — 63,5 °С, т. кип. 112,2°С, 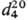 1,0194,
1,0194,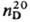 1,5203; для 3-метилтиофена соотв. -68,9°С, 115,4°С, 1,0216 и 1,5204.
1,5203; для 3-метилтиофена соотв. -68,9°С, 115,4°С, 1,0216 и 1,5204.
Тиофен относится к p-избыточным гетероароматич. системам и обладает выраженными ароматич. св-вами. В р-циях электроф. замещения (галогенирование, нитрование, фор-милирование, дейтерирование и др.) тиофен значительно активнее бензола (в нек-рых случаях в 100000 раз). Р-ции идут обычно (иногда исключительно) в a-положение цикла (на 2-3 порядка быстрее, чем в др. положение). Для производных тиофена, содержащих в положении 2 ориентанты II рода, р-ции идут с образованием 2,5-дизамещенных. 2,4-Изомеры получают, вводя в р-ции исходные соед. в виде комплексов с сильными протонными или апротонными к-тами, что объясняется резким увеличением электроноакцепторной способности заместителя в результате комплексообразова-ния:
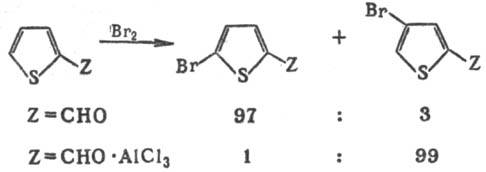
Тиофен и его производные менее стабильны, чем их бензольные аналоги, поэтому мн. р-ции в ряду тиофена сопровождаются поликонденсацией (смолообразованием) и деструкцией. Тиофен достаточно гладко алкилируется лишь в мягких условиях при использовании более активных третичных и вторичных (но не первичных) алкилгалогенидов. Тиофен и его замещенные, содержащие ориентанты I рода, очень легко ацилируются в присут. SnCl4 или SnCl2 в бензоле, к-рый в этих условиях не ацилируется. Формилирование тиофена протекает под действием ДМФА или N-метилформанилида в присут. РОС13; взаимод. с альдегидами и кетонами в присут. апротонных или протонных к-т приводит к образованию соед. ряда ди(2-тиенил)метана.
Тиофен и его производные способны к прямому металлирова-нию под действием литийорг. соед. по механизму т. наз. протофильного замещения. Р-ция протекает быстро и практически количественно при комнатной т-ре в большинстве случаев с высокой региоспецифичностью с образованием a-металлированных производных. В очень мягких условиях (—70 °С) под действием C4H9Li протекает также р-ция обмена атома галогена в цикле тиофена на металл, причем обмен галогена в a-положении предпочтительнее, чем в b-положе-нии, а обмен I на Li идет легче, чем Вг. В р-ции нуклеоф. замещения легко вступают гл. обр. замещенные тиофены, содержащие в цикле ориентанты II рода.
Тиофен, его гомологи и нек-рые производные способны к р-циям радикального замещения, напр. арилированию по Гомберга-Бахмана-Хея реакции. Др. важнейший способ арилирования-УФ облучение иодтиофена в ароматич. р-рителе или иодпроизводного ароматич. характера в тиофене.
Св-ва непредельных соед. выражены в тиофене слабо. Так, в диеновый синтез вступают только конденсированные тиофены, напр. замещенные бензо[с]тиофена. Гидрирование в ряду тиофена идет обычно с трудом, что связано с его отравляющим действием на мн. катализаторы. Тем не менее тиофен в присут. Pd/C, MoS2 и др. превращ. в тетрагидротиофен (тиофан, т. пл. -96,2°С, т. кип. 121,1 °С, 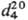 0,9987,
0,9987, 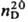 1,54048).
1,54048).
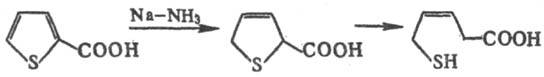
Гомологи тиофена и мн. замещенные легко превращ. в соответствующие производные тиофана в условиях ионного гидрирования, напр. при действии трифторуксусной к-ты и три-этилсилана. Дигидротиофен образуется при восстановлении тиофена Na в жидком NH3. При аналогичном восстановлении гомологов тиофена и его производных процесс обычно не останавливается на стадии образования дигидропроизводных, а происходит расщепление цикла с образованием соответствующих соед. алифатич. ряда, напр.:
При действии скелетного Ni с участием адсорбированного Н2 идет восстановит. десульфуризация замещенных тиофенов с образованием алифатич. соединений:
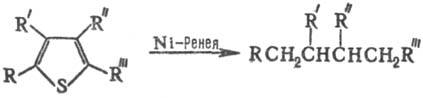
Эта р-ция-один из путей получения из производных тиофена соед. разл. классов, напр. карбоновых к-т, высших спиртов, простых эфиров, аминоспиртов и аминокислот, а также лакта-мов макроциклич. кетонов, кетокислот и кетолактонов.
Тиофен и его замещенные сравнительно устойчивы к действию окислителей. Однако при действии Н2О2 или надкислот происходит окисление до сульфоксида (в своб. состоянии не выделен) или до сульфона. Оба эти соед. представляют собой типичную диеновую систему, способную, напр., к диеновому синтезу, в к-ром они могут выполнять роль как диена, так и диенофила.
Под действием нек-рых алкилирующих агентов или ди-(этоксикарбонил)карбена образуются производные тиофена с положительно заряженным трехвалентным (сульфониевым) атомом серы, напр.:
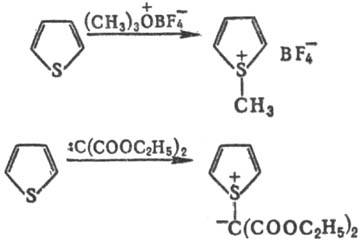
Тиофен и его гомологи содержатся в продуктах коксования каменного угля (откуда их и выделяют вместе с кам.-уг. бензолом) и продуктах термич. разложения сланцев (в нек-рых фракциях до 70% по массе). В сыром бензоле содержание тиофена составляет 1,3-1,4%, в получаемом из сырого бензола тиофено-бензольном концентрате-30-35%. Осн. сырье для синтеза тиофена и его гомологов-углеводороды нефтяных фракций С4 и С5, из к-рых они м.б. получены термич. взаимод. с S или каталитич. р-цией с H2S или SO2. Тиофен синтезируют также пропусканием фурана, ацетилена или 1,3-бутадиена и H2S над Аl2О3. Гомологи тиофена, а также нек-рые производные получают замыканием соответствующих 1,4-дикарбонильных соед. с помощью P2S5, напр.:
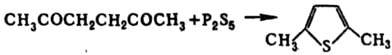
Соед. ряда тиофена-реагенты для разделения элементов, оптич. отбеливатели (на основе 2,5-тиофендикарбоновой к-ты), физиологически активные соединения. Мн. производные тиофена-лек. препараты (напр., антигельминтный препарат комбан-трин, модифицир. антибиотики цефалотин, цефалоридин), мономеры для получения электропроводящих полимеров.
Лит.: Блике Ф., в сб.: Гетероциклические соединения, под ред. Р. Элъдер-филда, пер. с англ., т. 1, М., 1953; Новые направления химии тиофена, М., 1976; Беленький Л. И., Гультяй В. П., "Химия гетероцикл. соединений", 1981, № 6, с. 723-43; Общая органическая химия, пер. с англ., т. 9, М., 1985, с. 229-93; Анисимов А. В., Викторова Е.А., Данилова Т. А., Молекулярные перегруппировки сероорганических соединений, М., 1989. Л. И. Беленький.
