Галогенангидриды
Галогенангидриды кислот, производные кислот, в которых гидроксильные группы замещены атомами галогенов. Примеры галогенангидридов: сульфурил хлористый SO2Cl2 [галогенангидрид серной кислоты H2SO4, т. е. SO2(OH)2], тионил хлористый SOCl2 [галогенангидрид сернистой кислоты, H2SO3 т. е. SO (OH)2], трёххлористый фосфор PCl3 [галогенангидрид фосфористой кислоты H3PO3, т. е. Р (ОН) з], ацетилхлорид СН3С OCl (галогенангидрид уксусной кислоты СН3СООН). Галогенангидриды обладают большой реакционной способностью: атом галогена в них может быть легко замещен на другие группы, например — ОН, — OR, — NH2, — SH, — CN. Во влажном воздухе хлорангидриды гидролизуются, образуя летучий хлористый водород («дымят»), например: SO2Cl2 + 2H2O = H2SO4 + 2HCl. Фторангидрид серной кислоты — фтористый сульфурил SO2F2 к гидролизу устойчив. В органическом синтезе галогенангидриды органических кислот используют для введения группы RCO (ацильная группа) в молекулы каких-либо соединений (реакция ацилирования):
RCOCl + HOR' ® RCOOR' + HCI.
Для этой цели чаще всего используют хлорангидриды органических кислот, получаемые взаимодействием карболовых кислот с хлорангидридами неорганических кислот (РСlз, PCI5, SOCl2):
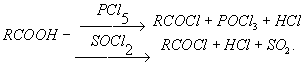
Галогенангидриды большинства неорганических кислот, а также хлорангидриды низших карбоновых кислот алифатического ряда — жидкости с крайне резким запахом.

Дополнения к описанию галогенангидридов: