Ангидриды кислот
Ангидриды кислот легче всего могут быть получены действием галоидангидридов на безводные соли тех же кислот;
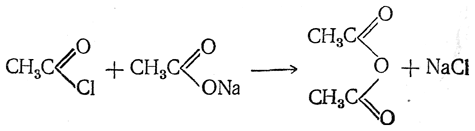
При взаимодействии солей жирных кислот со многими неорганическими хлорангидридами и ангидридами (SO2Cl2, SOCl2, COCl2, N2O4 и т. п.) также легко получаются ангидриды кислот. Например:
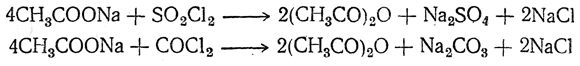
Ангидриды низших жирных кислот представляют собой жидкости, кипящие выше, чем соответствующие хлорангидриды, и обладающие острым запахом.
С безводным хлористым водородом при нагревании ангидриды могут реагировать, образуя хлорангидрид и кислоту:
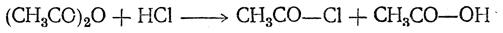
Большая часть реакций ангидридов совершенно тождественна реакциям хлор ангидридов, но при этом вместо хлористого водорода образуется органическая кислота:
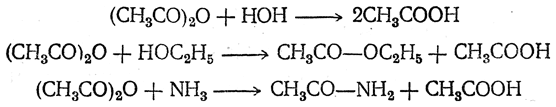
Первая реакция оправдывает присвоенное этим веществам название ангидридов.
Из сказанного видно, что ангидриды кислот, как и галоидангидриды, являются ацилирующими средствами. Реакции ацилирования протекают с ангидридами значительно менее энергично, чем с хлорангидридами, что дает возможность выбирать ацилирующее средство в зависимости от желательных условий реакции.
Уксусный ангидрид (СН3СО)2О кипит при 140° С; относительная плотность d204 = 1,073. С водой он не смешивается и лишь немного в ней растворяется. Растворенный ангидрид на холоду медленно реагирует с водой, превращаясь в уксусную кислоту.
Уксусный ангидрид находит значительное применение как средство ацетилирования в лабораторных синтезах и в технике (например, в производстве ацетата целлюлозы). Он легко получается действием кетена на безводную уксусную кислоту:
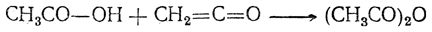
Ангидрид муравьиной кислоты неизвестен.


