Уксусной кислоты ангидрид
Синонимы:
ацетангидридуксусный ангидрид
Внешний вид:
бесцветн. жидкостьБрутто-формула (система Хилла): C4H6O3
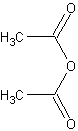
Формула в виде текста: (CH3CO)2O
Молекулярная масса (в а.е.м.): 102,09
Температура плавления (в °C): -73,1
Температура кипения (в °C): 139,6
Растворимость (в г/100 г или характеристика):
бензол: растворимвода: 13,6 (20°C)
вода: реагирует (100°C)
диэтиловый эфир: смешивается
тетрагидрофуран: растворим
уксусная кислота: растворим
хлороформ: растворим
этанол: реагирует
Вкус, запах, гигроскопичность:
запах: резкийМетод получения 1.
(лабораторный синтез)Источник информации: Гаттерман Л., Виланд Г. "Практические работы по органической химии" 5-е изд., М.-Л.: ГНТИХЛ, 1948 стр. 169
К 80 г тонкоизмельченного безводного уксуснокислого натрия прибавляют по каплям из капельной воронки 54 г (0,75 моля) хлористого ацетила. После прибавления примерно половинного количества хлорангидрида реакцию прерывают на короткое время и перемешивают кашицеобразную массу стеклянной палочкой, несколько согнутой и сплющенной на конце. Только после этого прибавляют остаток хлористого ацетила; прибавление его ведут настолько медленно, чтобы не вошедший в реакцию хлористый ацетил не отгонялся.
По окончании реакции отгоняют полученный ангидрид от избытка соли, нагревая колбу коптящим пламенем (непрерывно обводят им колбу). Дестиллат подвергают фракционированной перегонке, прибавляя к нему 3 г тонкоизмельченного безводного уксуснокислого натрия, чтобы полностью перевести остатки хлористого ацетила в уксусный ангидрид.
Температура кипения чистого уксусного ангидрида 138°. Выход 55—60 г.
Способы получения:
1. Реакцией фосгена с ледяной уксусной кислотой в присутствии хлорида алюминия.2. Реакцией ацетата натрия с двуокисью азота.
3. Разложением уксусной кислоты в присутствии триэтилфосфата (0,3%) при 680-720 С и давлении 26,2-52,4 кПа. (выход 80%)
4. Окислением ацетальдегида в присутствии меднокобальтового катализатора при 50-60 С. (выход 16%)
5. Карбонилированием метилацетата в присутствии гомогенных родиевых катализаторов.
6. Разложением этилидендиацетата в присутствии хлорида цинка.
7. Реакцией кетена с ледяной уксусной кислотой.
8. Реакцией уксусной кислоты с неорганическими галогенангидридами (тионилхлоридом, сульфурилхлоридом, трихлороксидом фосфора.)
Плотность:
1,082 (20°C, г/см3)Показатель преломления (для D-линии натрия):
1,3904 (20°C)Давление паров (в мм.рт.ст.):
15 (44,6°C)100 (82,2°C)
Дипольный момент молекулы (в дебаях):
2,82 (20°C)Динамическая вязкость жидкостей и газов (в мПа·с):
0,9 (18°C)0,49 (100°C)
Поверхностное натяжение (в мН/м):
32,7 (20°C)31,22 (30°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-624,42 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-489,14 (ж)Энтальпия кипения ΔHкип (кДж/моль):
276,7Температура вспышки в воздухе (°C):
40Температура самовоспламенения на воздухе (°C):
360Теплота сгорания Qp (кДж/моль):
1807Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-576,1 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-477 (г)Разные дозы:
ПДКатмосф. = 30 мг/л.Симптомы острого отравления:
Раздражает глаза и дыхательные пути, вызывает ожоги кожи.
Критическая температура (в °C):
295,8Критическое давление (в МПа):
4,68Применение:
Применяется как ацетилирующий агент в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств, красителей, душистых веществ.
Дополнительная информация:
Медленно реагирует с водой с образованием уксусной кислоты. С основаниями дает ацетаты, с хлороводородом и фосгеном при 70-80 С - ацетилхлорид, со спиртами - сложные эфиры, с тиолами - тиоэфиры, с аминами - амиды, с альдегидами в присутствии кислых катализаторов - диацетаты, с ароматическими альдегидами в присутствии ацетата калия - бета-арилакриловые кислоты. Ацетилирует целлюлозу, превращает высшие жирные кислоты в ангидриды, алифатические и жирноароматические кетоны в присутствии трифторида бора - в бета-дикетоны.
Входит в список IV (прекурсоры) наркотических и психотропных веществ. Мировое производство 1,1-1,3 млн. тонн (1988 г).
- "Химическая энциклопедия" т.3 М.: Советская энциклопедия, 1992 стр. 180
- "Химическая энциклопедия" т.5 М.: Советская энциклопедия, 1999 стр. 33
- Бабаян Э.А., Гаевский А.В., Бардин Е.В. "Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров" М.: МЦФЭР, 2000 стр. 147
- Некрасов Б.В. "Основы общей химии" т.1 М.:Химия, 1973 стр. 563
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 126
