Карбоновые кислоты
Карбоновые кислоты, класс органических соединений, содержащих карбоксильную группу (карбоксил) 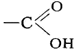 . В зависимости от природы радикала, связанного с группой — COOH, карбоновые кислоты могут принадлежать к алифатическому (жирному), алициклическому, ароматическому или гетероциклическому ряду. По числу карбоксильных групп в молекуле различают одно-, двух- и многоосновные (соответственно моно-, ди- и поликарбоновые) кислоты. Кроме того, карбоновые кислоты могут быть насыщенными (предельными) и ненасыщенными (непредельными), содержащими в молекулах двойные или тройные связи.
. В зависимости от природы радикала, связанного с группой — COOH, карбоновые кислоты могут принадлежать к алифатическому (жирному), алициклическому, ароматическому или гетероциклическому ряду. По числу карбоксильных групп в молекуле различают одно-, двух- и многоосновные (соответственно моно-, ди- и поликарбоновые) кислоты. Кроме того, карбоновые кислоты могут быть насыщенными (предельными) и ненасыщенными (непредельными), содержащими в молекулах двойные или тройные связи.
Большинство карбоновых кислот имеет тривиальные названия, многие из которых связаны с их нахождением в природе, например муравьиная, яблочная, валериановая, лимонная кислоты. По Женевской номенклатуре наименования карбоновых кислот производят от названий углеводородов с тем же числом атомов углерода, прибавляя окончание «овая» и слово «кислота», например метановая кислота (муравьиная), этановая кислота (уксусная) и т.д. Нередко карбоновые кислоты рассматривают как производные углеводородов; например, кислоту строения HC º С — COOH называют ацетиленкарбоновой кислотой.
Кислотные свойства обусловлены способностью карбоновых кислот к диссоциации в водном растворе:
RCOOH Û RCOO- + H+.
Как правило, карбоновые кислоты слабее минеральных. Константы диссоциации одноосновных насыщенных кислот жирного ряда при 25°С изменяются от 1,7×10-4 (муравьиная кислота) до 1,3.10-5 (высшие гомологи). Сила карбоновых кислот существенно зависит также от электрофильности радикала, связанного с карбоксилом. Введение электроотрицательных заместителей (например, NO2, CN, Cl) в положение, соседнее с карбоксильной группой, резко повышает кислотность, например циануксусная кислота CNCH2COOH примерно в 200 раз сильнее уксусной кислоты CH3COOH. По мере удаления от карбоксила влияние заместителей ослабевает. Дикарбоновые кислоты сильнее монокарбоновых, причём влияние одного карбоксила на другой тем больше, чем они ближе расположены друг к другу. Так, в ряду кислот щавелевая кислота HOOC—COOH сильнее малоновой кислоты HOOCCH2COOH, которая, в свою очередь, сильнее янтарной HOOC (CH2)2COOH, и т.д. Кислотность непредельных кислот выше, чем предельных; влияние двойной связи тем сильнее, чем она ближе расположена к карбоксилу. Так, акриловая кислота CH2=CH—СООН в 4 раза сильнее пропионовой CH3—CH2—COOH. Ароматические кислоты сильнее предельных алифатических (например, константа диссоциации бензойной кислоты 6,5.10-5).
Карбоновые кислоты — жидкие (например, низшие жирные кислоты) или твёрдые (например, высшие жирные и ароматические кислоты) вещества (см. табл.). Низшие члены насыщенных карбоновых кислот жирного ряда хорошо растворимы в воде, средние члены (C4 — C10), а также ароматические кислоты — ограниченно, высшие жирные кислоты в воде не растворимы; как и ароматические кислоты, они хорошо растворяются в спирте, эфире, бензоле.
Наиболее важные химические свойства карбоновых кислот — способность превращаться в производные. При взаимодействии с основаниями карбоновые кислоты дают соли:
RCOOH + NaOH ® RCOONa + H2O.
При действии на карбоновые кислоты спиртов в присутствии минеральных кислот легко образуются эфиры сложные:
RCOOH + R'OH ® RCOOR' + H2O;
при действии галогенангидридов минеральных кислот (например, PCl3, POCl3, SOCl2)— галогенангидриды карбоновых кислот RCOX (X — атом галогена). При нагревании кислот с водоотнимающими средствами получаются ангидриды карбоновых кислот (RCO)2O. Галогенангидриды и ангидриды карбоновых кислот применяют как ацилирующие агенты. Отщепление воды от аммониевых солей карбоновых кислот (1) и реакция галогенангидридов с аммиаком (2) приводят к амидам кислот:
1) RCOONH4 ® RCONH2 + H2O
2) RCOCI + 2NH3 ® RCONH2 + NH4CI.
Методы получения карбоновых кислот весьма многочисленны. Окислением первичных спиртов и альдегидов получают карбоновые кислоты с тем же числом атомов углерода. Окисление кетонов сопровождается разрывом связи С—С; из циклических кетонов образуются дикарбоновые кислоты, например адипиновая кислота из циклогексанона:
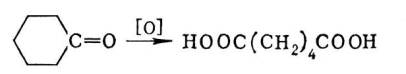
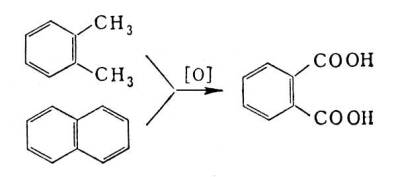
Насыщенные углеводороды могут быть подвергнуты деструктивному окислению с образованием смеси продуктов, в том числе и карбоновых кислот. Этим методом из 1 m парафина обычно получают около 350 кг карбоновых кислот. Окисление боковой цепи жирно-ароматических углеводородов либо многоядерных ароматических углеводородов приводит к ароматическим карбоновым кислотам; например, фталевая кислота получается окислением о-ксилола или нафталина:
Ненасыщенные углеводороды окисляются по месту двойной связи:
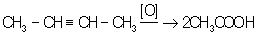 .
.
Важный метод синтеза карбоновых кислот — гидролиз их нитрилов, легко получаемых взаимодействием галогенопроизводных углеводородов с цианистым натрием:
RCI + NaCN ® RCN ® RCOOH.
В настоящее время промышленное значение приобрёл метод синтеза карбоновых кислот карбонилированием, т. е. введением группы CO в органические соединения:
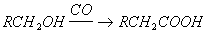
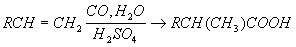
Некоторые карбоновые кислоты получают из природных продуктов. Так, щелочным гидролизом (омылением) жиров получают соли высших жирных кислот (мыла) и глицерин. Лимонную кислоту получают из ботвы хлопчатника и из стеблей махорки (после выделения из них никотина). Многие карбоновые кислоты получают сбраживанием углеводов в присутствии бактерий определённого вида (маслянокислое, молочнокислое, лимоннокислое и др. виды брожения).
Карбоновые кислоты широко распространены в природе в свободном состоянии и в виде производных (главным образом сложных эфиров). Так, в летучем масле герани содержится пеларгоновая кислота, в лимонах — лимонная. В состав животных и растительных жиров и масел входят глицериды высших нормальных карбоновых кислот жирного ряда, из которых преобладают пальмитиновая кислота, стеариновая кислота и олеиновая кислота.
Карбоновые кислоты, их производные, а также многочисленные соединения, содержащие наряду с карбоксильной иные функциональные группы (например, аминокислоты, оксикислоты и др.), имеют большое биологическое значение и находят разнообразное практическое применение. Муравьиную и уксусную кислоты, например, применяют при крашении и печатании тканей; уксусную кислоту и уксусный ангидрид — в производстве ацетилцеллюлозы. Аминокислоты входят в состав белков. В медицине используют салициловую кислоту, n-аминосалициловую кислоту (ПАСК) и др.
Высшие жирные карбоновые кислоты широко применяют как сырьё для производства мыла, лаков и красок, поверхностно-активных веществ, как эмульгаторы в производстве каучуков, как пластификаторы в производстве резин и др. Адипиновая кислота — один из исходных продуктов в производстве полиамидного волокна (найлона), терефталевая — в производстве полиэфирного волокна (лавсана, терилена), полимерный нитрил акриловой кислоты (орлон) применяют как синтетическое волокно, близкое по свойствам к натуральной шерсти. Полимеры и сополимеры эфиров метакриловой кислоты используют как органическое стекло.
Некоторые представители карбоновых кислот и их свойства
| Наименование | Формула | Температура плавления, °С | Температура кипения, °С | Плотность,* г/см2 | |
| Алифатические (жирные) кислоты | |||||
| Муравьиная | НСООН | 8,4 | 100,5 | 1,220(20) | |
| Уксусная | СН3СООН | 16,6 | 118,2 | 1,049(20) | |
| Пеларгоновая | СН3(СН2)7СООН | 12,3 | 255,6
| 0,906(20) | |
| Пальмитиновая
| СН3(СН2)14СООН | 62,8 | 390 | 0,841(80) | |
| Стеариновая
| СН3(СН2)16СООН | 69,6 | 360 (с разложением) | 0,839(80) | |
| Адипиновая
| НООС(СН2)4СООН | 153,5 | 265(100 мм рт. ст.)** | 1,366(20) | |
| Акриловая | СН2=СНСООН | 12,3 | 140,0 | 1,062(16) | |
| Метакриловая | СН2=С(СНЗ)СООН | 16 | 163 | 1,015(20) | |
| Олеиновая | СН3(СН2)7СН=СН(СН2)7СООН | 16 | 223(10 мм рт. ст.) | 0,895(18) | |
| Ароматические кислоты | |||||
| Бензойная | С6Н5СООН | 121,7 | 249,2 | 1.322(20) | |
| Коричная | С6Н5СН=СНСООН | 136 | 300 | 1,245(20) | |
| Терефталевая | n=НООСС6Н4СООН | — | 300 (возгоняется) | — | |
*В скобках указана температура (в °С). ** 1 мм рт. ст. = 133,322 н/м2.
Лит.: Неницеску К. Д., Органическая химия, пер. с рум., т. 1—2, М., 1962—1963; Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1—2, М., 1969—70.
