Предельные одноосновные кислоты жирного ряда
Органические кислоты, кислотные свойства которых связаны с присутствием в молекуле одновалентного радикала карбоксила
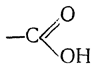
называются карбоновыми кислотами. По числу карбоксилов в молекуле различают кислоты одноосновные, двухосновные и многоосновные.
Предельные жирные кислоты можно рассматривать как производные парафиновых углеводородов, происшедшие в результате замещения атома водорода на карбоксил. Таким образом, общая формула этих кислот Cn'H2n'+1—СООН, или CnH2nO2 (принимая п = п' + 1). Следовательно, число изомеров жирных кислот (как и альдегидов) будет совпадать с числом изомеров, например, галоидных соединений и спиртов, содержащих в молекуле на один атом углерода меньше, чем кислота.
Если производить кислоты от парафиновых углеводородов, то первым членом этого ряда являлась бы кислота строения СН3—СООН, т. е. метанкарбоновая, или уксусная, кислота. Однако аналогично некоторым другим случаям в качестве первого члена этого ряда рассматривают муравьиную кислоту Н—СООН, представляющую собой соединение карбоксила с водородом.
Высшие кислоты можно также рассматривать как производные уксусной кислоты — продукты замещения атомов водорода в метиле на алкильные группы. Тогда пропионовую, или этанкарбоновую, кислоту СН3—СН2—СООН можно назвать метилуксусной кислотой, изомасляную (СН3)2СН—СООН — диметилуксусной кислотой и т. д.
По женевской номенклатуре, названия кислот производятся от названий углеводородов с тем же числом атомов углерода, с прибавлением слова кислота, обозначающего наличие в молекуле карбоксила. Таким образом, муравьиная кислота называется метановой кислотой, уксусная — этановой кислотой, кислота строения
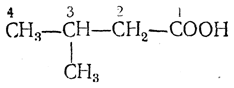
3-метилбутановой кислотой и т. д.
Наиболее употребительными являются более или менее случайные названия кислот, связанные с каким-либо из источников их получения или с местонахождением в природе; эти названия приведены в табл. 10.
При действии щелочей карбоновые кислоты образуют соли, причем экспериментально установлено, что в карбоксильной группе соли, как и в карбоксильной группе кислоты, оба кислородных атома равноценны; так, например, в формиате натрия угол между связями О—С—О равен 124 ±4°, а оба расстояния С—О равны и составляют 1,27 Å. Поэтому строение солей карбоновых кислот может быть изображено формулой:
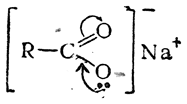
(кривыми стрелками показано направление смещения электронной плотности в результате взаимного влияния атомов).


