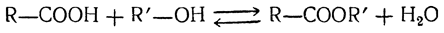Химические свойства
1. Кислотные свойства. Уже в спиртах гидроксильный (т. е. связанный с кислородом) атом водорода обладает способностью замещаться такими энергичными металлами, как калий и натрий. Однако кислотные свойства спиртового гидроксила слишком слабы, и алкоголяты разлагаются водой на спирт и едкую щелочь. Алкоголи являются настолько слабыми кислотами, что даже с самыми чувствительными индикаторами не показывают кислой реакции.
В карбоксиле кислотные свойства гидроксильного водорода чрезвычайно усиливаются, и карбоксильная группировка сообщает веществу отчетливо выраженные кислотные свойства (монокарбоновые кислоты имеют обычно константу диссоциации порядка 10–4—10–5).
Это обусловливается двумя причинами.
С одной стороны, электронная плотность смещается в направлении обладающего большим электроносродством электрофильного заместителя — кислорода карбонильной группы. Тем самым ослабляется связь между водородом и гидроксильным кислородом и облегчается удаление атома водорода в виде протона, т. е. равновесие диссоциации

смещается вправо.
В алифатических спиртах нет электрофильного заместителя, подобного карбонильному кислороду. Поэтому, хотя в спиртах водород гидроксильной группы может замещаться на металл, они все же являются даже более слабыми кислотами, чем вода (константы диссоциации спиртов меньше 10–14).
Таким образом, на примере кислот обнаруживается влияние на атом водорода кислородного атома, связанного с ним не непосредственно, а лишь через посредство атома углерода.
Однако, с другой стороны, на кислотность карбоксильной группы оказывают влияние также и радикалы, с ней связанные. Так, константы электролитической диссоциации, которые являются мерой силы кислот, для первых членов ряда жирных кислот имеют следующие величины:
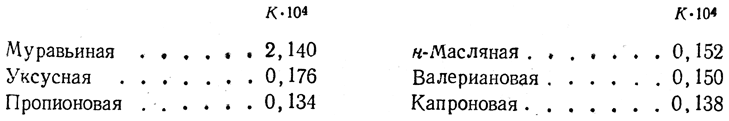
Эти данные показывают, что все жирные кислоты, за исключением муравьиной, которая является кислотой средней силы, представляют собой довольно слабые кислоты. Соли их со щелочными металлами в водных растворах сильно гидролизованы и имеют щелочную реакцию.
2. Электролиз жирных кислот и их солей. В водных растворах кислоты и их соли диссоциируют на катионы водорода или металла и анионы жирных кислот R—СОО–. Последние, теряя на аноде заряд, могут распадаться на СО2 и алкил R, после чего благодаря соединению двух алкилов обычно образуются углеводороды парафинового ряда R—R (реакции Кольбе), например:
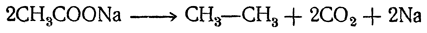
Как показал Фихтер, при электролизе солей органических кислот на аноде промежуточно образуются перекиси кислот:
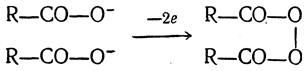
которые при подходящих условиях могут быть обнаружены.
Эти перекиси расщепляются на радикалы, в свою очередь распадающиеся далее на СО2 и алифатические радикалы:
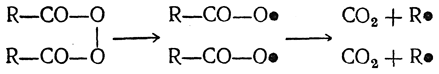
При достаточно большой плотности тока на аноде образовавшиеся алифатические радикалы димеризуются в предельные углеводороды R—R, а при малых плотностях тока стабилизуются с образованием, наряду с другими продуктами, углеводородов R—Н и непредельных углеводородов. Эта схема не объясняет, однако, всех особенностей электролиза солей жирных кислот. Так, если при электролизе на аноде выделяется кислород (например, при прибавлении к электролиту сульфата натрия), то алкилы окисляются в соответствующие спирты:
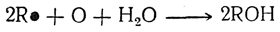
3. Образование предельных углеводородов при сплавлении солей со шелочами. Сплавлением соли щелочного металла с едкой щелочью можно получить па-
рафиновый углеводород с меньшим числом атомов углерода в молекуле:
4. Образование альдегидов и кето нов. Перегонкой кальциевых солей жирных кислот получаются кетоны, а из смесей, содержащих муравьинокислый кальций, — альдегиды.
Альдегиды и кетоны получаются также при пропускании паров жирной кислоты или смеси жирной кислоты с муравьиной кислотой над некоторыми солями или окислами металлов.
5. Действие галоидов. При действии галоидов на кислоты происходит замещение на галоид водорода в алкилах и получаются галоидзамещенные кислоты, например:
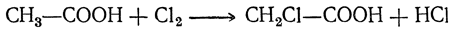
Полученная монохлорзамещенная кислота реагирует дальше с хлором вплоть до образования кислоты СCl3—СООН.
Очень часто действуют галоидом не на кислоту, а на ее галоидангидрид или ангидрид (способ Зелинского—Геля—Фольгарда), например:
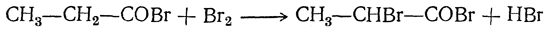
При этом легко замещаются на галоид лишь те атомы водорода, которые связаны с атомом углерода, соседним с карбоксильной группой. Это объясняется смещением электронной плотности под влиянием карбоксильной группы:
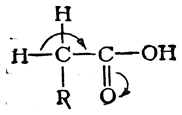
В результате происходит ослабление связей С—Н и α-атомы водорода становятся более подвижными.
6. Действие галоидных соединений фосфора. При действии галоидных соединений фосфора на кислоты происходит замена гидроксила на галоид и получаются галоидангидриды кислот. Как и при замещении на галоид спиртового гидроксила, можно действовать пятигалоидными или трехгалоидными соединениями фосфора, а также соединениями типа хлорокиси фосфора:
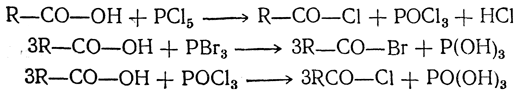
Аналогично реагируют с кислотами некоторые галоидные соединения серы (SOCl2, SO2Cl2).
7. Действие окислителей. Окислители в большинстве случаев лишь с трудом реагируют с жирными кислотами, причем под их действием происходит разрушение молекулы кислоты. Однако разбавленная перекись водорода медленно окисляет жирные кислоты с образованием сначала оксикислот, а при дальнейшем окислении — кетонокислот. Окисление происходит в (β-положении (Дэкин):
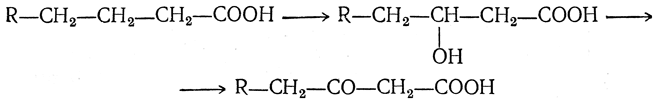
Кетонокислоты неустойчивы и тут же декарбоксилируются:
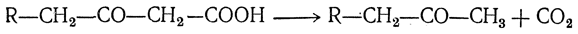
Если в молекуле исходной жирной кислоты имеется третичный атом углерода, т. е. группа СН, реакция окисления останавливается на стадии образования оксикислоты с тем же числом атомов углерода в молекуле:

Сходные конечные продукты образуются при окислении жирных кислот в живом организме. В этом случае первой стадией является отщепление двух атомов водорода в α,β-положении, после чего происходит присоединение воды:

Далее получается β-кетокислота и т. д.
В живом организме кислоты могут окисляться и в ω-положении (так обозначается положение, наиболее удаленное от функциональной группы, в данном случае — от карбоксильной) с образованием двухосновных кислот (Веркаде):
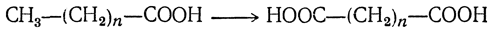
8. Восстановление. Восстановлением кислот можно получить соответствующий альдегид и затем первичный спирт.
Очень энергичным восстановлением можно превратить карбоксил в метил, так что окончательным продуктом реакции будет парафиновый углеводород с тем же числом атомов углерода в молекуле.
9. Образование амидов и нитрилов. При нагревании аммонийных солей жирных кислот выделяется молекула воды и получается амид кислоты:
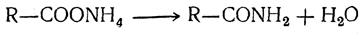
При дальнейшем нагревании с водоотнимающими средствами, например с фосфорным ангидридом, выделяется вторая молекула воды и получается нитрил кислоты (цианистое соединение):
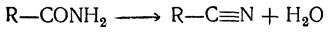
10. Образование сложных эф и ров. Действием кислот на спирты получаются сложные эфиры жирных кислот (ср. стр. 205 сл.), например: