Галогенониевые соединения
ГАЛОГЕНОНИЕВЫЕ СОЕДИНЕНИЯ, содержат положительно заряженный атом галогена (С1, Вг, I), связанный ковалентно с двумя орг. радикалами и ионной связью с анионом, напр. 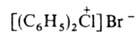 ,
,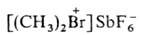 .
.
Известны след, типы галогенониевых соединений
1. Ароматич.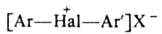 , где X-анион сильной к-ты, Аr и Аr'-одинаковые или разные ароматич. радикалы, гетероциклич. радикалы ароматич. характера (тиснил, Hal = I, Вr; фурил, индолил, Hal = I) или элементоорг. радикалы (12-карборанил, Hal = I, Br, C1).
, где X-анион сильной к-ты, Аr и Аr'-одинаковые или разные ароматич. радикалы, гетероциклич. радикалы ароматич. характера (тиснил, Hal = I, Вr; фурил, индолил, Hal = I) или элементоорг. радикалы (12-карборанил, Hal = I, Br, C1).
2. Ароматические с атомом галогена в цикле (ф-ла I), где R = Н или к.-л. заместитель; X = анион; Y = —О—, -NH-, -S-, -SO- -S02-, -СО-, -(СН2)n- (п =0, 1, 2, 3),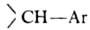 и др.
и др. 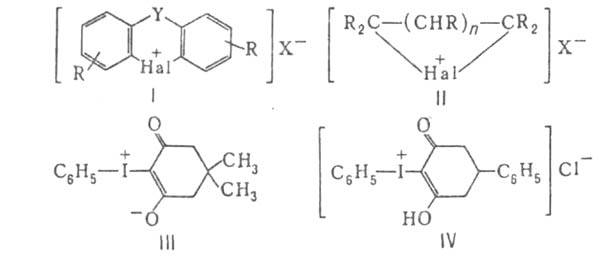
3. Алифатич.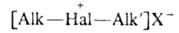 и жирноароматич.
и жирноароматич.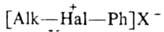 , где Alk и Alk'-одинаковые или разные, Х-чаще всего SbF6-.
, где Alk и Alk'-одинаковые или разные, Х-чаще всего SbF6-.
4. Алифатические с атомом галогена в цикле (ф-ла И), где п = 0-3; R = Н, Alk; X = SbF6-.
5. Цодониевые соед., содержащие ненасыщ. радикалы:
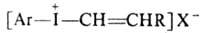 ,
,
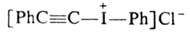 и
и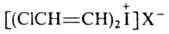 (транс).
(транс).
6. Иодониевые соед. из дикетонов, напр. ф-лы III и IV.
дикетонов, напр. ф-лы III и IV.
Свойства. галогенониевых соединений-твердые солеобразные в-ва с высокими т-рами плавления (120-250 °С); раств. в полярных р-рителях (ацетон, CH3NO2, C6H5NO2, CH3CN, ДМФА и др.), не раств. в эфире и углеводородах. Ароматич. галогенониевые соединения с анионами NO3-, HCOO-, AcO-, HSO4- обычно раств. в воде, с анионами Br-, I-, HgB3-, PtCl62- , как правило, плохо раств. в воде. Алифатич. галогенониевые соединения могут существовать только с комплексными анионами. Они сравнительно устойчивы лишь в р-рах (обычно в жидком SO2) при т-рах не выше — 40 °С. В твердом виде выделено лишь неск. соединений, напр.
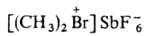
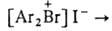
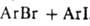 .
.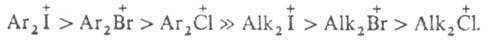
Алифатич. галогенониевые соединения-сильные алкилирующие агенты, передающие алкил-катион практически любому орг. соед. кислорода, азота или серы, имеющему неподеленные пары электронов на гетероатоме, напр.: 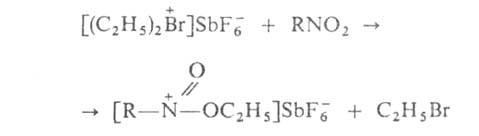
Соед.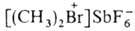 , в отличие от третичных алифатич. оксониевых соед., метилирует даже RHal и ArHal с образованием новых галогенониевых соединений.
, в отличие от третичных алифатич. оксониевых соед., метилирует даже RHal и ArHal с образованием новых галогенониевых соединений.
Диарилгалогенониевые соед. - хорошие арилирующие агенты, способные как к гомолитич., так и гетеролитич. арилированию; их катионы легко арилируют разл. нуклеофилы, напр.: 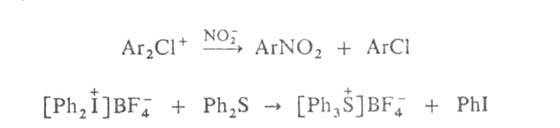
Подобно ароматич. солям диазония галогениды ароматич. галогенониевых соединений образуют металлоорг. соед. с Hg, Sb, Те, Sn, Tl, Pb, Bi, напр.:
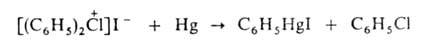
С галогенидами тяжелых металлов ароматич. галогенониевые соединения дают двойные соли, при разложении к-рых порошками металлов образуются металлоорг. соед. (как и по р-ции Несмеянова): 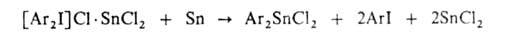
Соли дифенилгалогенониев легко нитруются нитрующей смесью с образованием ди-мета-нитропроизводных. Скорость нитрования заметно убывает в ряду: 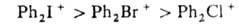
Получение и применение. Ароматич. иодониевые соед. обычно получают след. методами:
1. Взаимод. АrIС12 (или IС13) с ароматич. соед. Hg или Sn, напр.: 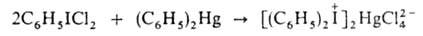
Этим методом были получены и иодониевые соед. с ненасыщ. радикалами, напр.: 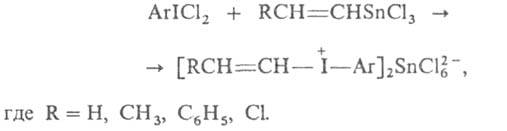
2. Конденсацией аренов с АrIO или ArI(OAc)2 в присут. конц. H2SO4: 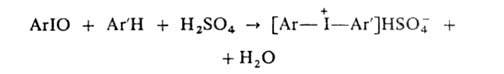
причем АгЮ можно получать in situ из Arl и окислителя (K2S2O8, BaO2, СН3СО3Н и др.).
3. Взаимод. гидрокси(тозилокси)нодаренов с арилтриметилсиланами в инертном р-рителе: 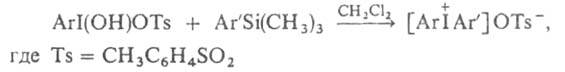
Аналогично можно получить и любые арилалкенилиодониевые соли, напр.: 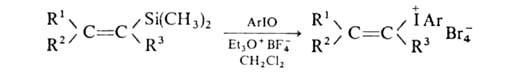
4. Действием влажного оксида серебра или NaOH на эквимолярную смесь АrIO и АrIO2: 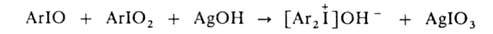
Все ароматич. галогенониевые соединения получают нагреванием ароматич. диазосоединений с арилгалогенидами: 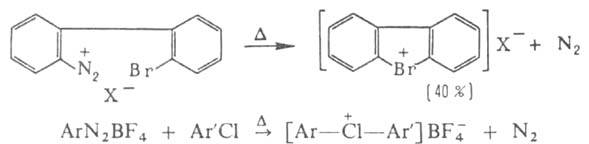
Несмотря на низкие выходы (5-15%) целевого продукта, этот метод пока единственный для получения ароматич. хлорониевых соединений.
Ароматич. бромониевые соед. можно получать с выходом 50-95% низкотемпературной ( — 70 °С) конденсацией BrF3 или ArBrF2 (в присут. CH3CN и Et2O*BF3) с аренами, а также с Ar2Hg или с Ar4Sn, напр.: 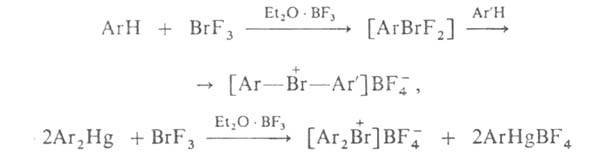
Алифатич. галогенониевые соединения получают в атмосфере сухого азота, при полном исключении влаги, в осн. двумя методами: а) взаимод. избытка моно- или дигалогеналкана с комплексом SbF5*SO2, безводной фторсурьмяной к-той (HF*SbF5) или с безводным AgSbF6 в жидком SO2 при т-рах от — 60 до -78°С, напр.: 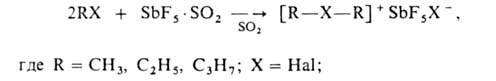
б) алкилированием галогеналканов метил- или этилгексафторантимонатами в жидком SO2 при — 60 °С, например: 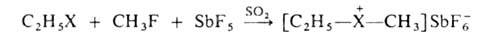
Галогенониевые соединения применяют в лаб. практике как алкилирующие и арилирующие агенты. Они обладают широким спектром бактериостатич. действия.
Литература
Реутов О. А., Макарова Л. Г., Толстая Т.П., "Ж. орган, химии", 1969, т. 5, в. 9, с. 1521-38; Reutov О. A., Ptitsyna О. A., "Organometallic Reactions", 1972, v. 4, p. 73-162; Varvoglis A., "Synthesis", 1984, № 9, p. 709-26. Т.П. Толстая.
