Галогенальдегиды и галогенкетоны
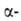 ,
,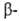 ,
,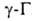 . и г. и т. д. Они вступают в р-ции, свойственные как галогензамещенным углеводородам, так и карбонильным соединениям. Влияние карбонильной группы на атом галогена зависит от его положения в молекуле. Так, облегчается нуклеоф. замещение галогена в
. и г. и т. д. Они вступают в р-ции, свойственные как галогензамещенным углеводородам, так и карбонильным соединениям. Влияние карбонильной группы на атом галогена зависит от его положения в молекуле. Так, облегчается нуклеоф. замещение галогена в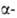 положении (ур-ние 1); при действии оснований обычно легко отщепляется галогене водород от соединений, содержащих атом галогена в
положении (ур-ние 1); при действии оснований обычно легко отщепляется галогене водород от соединений, содержащих атом галогена в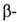 положении (2):
положении (2):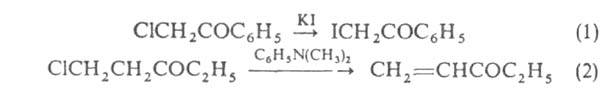
С нек-рыми бифункциональными соединениями галогенальдегиды и галогенкетоны образуют гетероциклы: 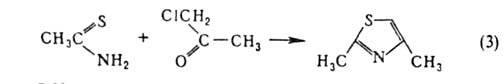
 Ненасыщенные галогенальдегиды и галогенкетоны с атомом галогена в
Ненасыщенные галогенальдегиды и галогенкетоны с атомом галогена в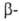 положении способны перегруппировываться вследствие миграции атомов галогена и кислорода:
положении способны перегруппировываться вследствие миграции атомов галогена и кислорода: 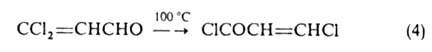
Для галогенальдегидов и галогенкетонов с атомом галогена в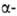 положении характерны Перкова реакция, Дарзана реакция, перегруппировка Фаворского (см. Фаворского реакции).
положении характерны Перкова реакция, Дарзана реакция, перегруппировка Фаворского (см. Фаворского реакции).
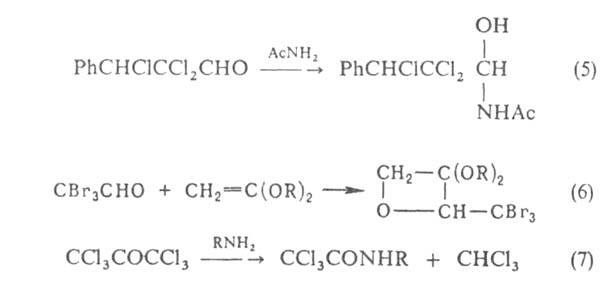
Накопление атомов галогена в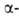 положении приводит к увеличению электроф. реакц. способности карбонильной группы. Это способствует образованию устойчивых аддуктов галогенальдегидов и галогенкетонов со слабыми нуклеофилами (ур-ния 5,6), а также ослаблению связи между карбонильным и галогенированным атомами углерода, вследствие чего при действии оснований наблюдается галоформное расщепление (7):
положении приводит к увеличению электроф. реакц. способности карбонильной группы. Это способствует образованию устойчивых аддуктов галогенальдегидов и галогенкетонов со слабыми нуклеофилами (ур-ния 5,6), а также ослаблению связи между карбонильным и галогенированным атомами углерода, вследствие чего при действии оснований наблюдается галоформное расщепление (7):
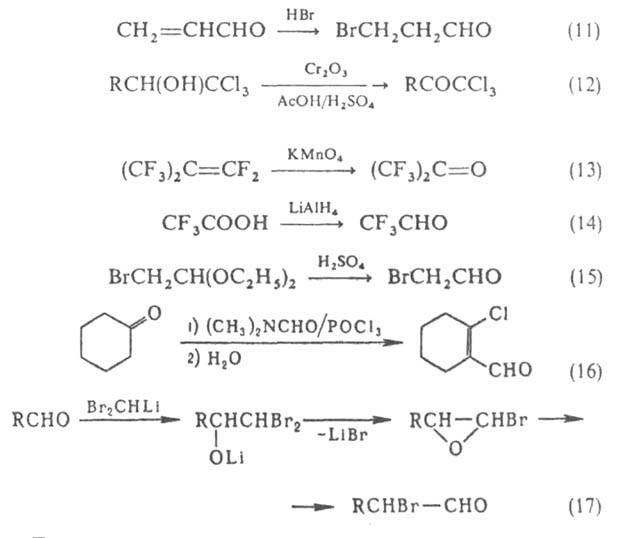
Методы получения галогенальдегидов и галогенкетонов: введение галогена в карбонильное соед. (ур-ния 8-11); создание альдегидной или кетогруппы посредством окисления (12, 13), восстановления (14), гидролиза (15); одноврем. введение галогена и карбонильной группы (16) (см. также Кондакова реакция); изомеризация галогенсодержащих оксиранов (17):
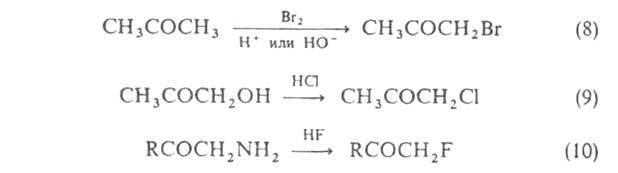
Галогенальдегиды и галогенкетоны используют для синтеза гетероциклич. соединений, производных диарилметанов, фосфорорг. инсектицидов и др. См. также Гексафторацетон, Полифторкетоны, Хлоралъ.
Литература
Бреттль Р., в кн.: Общая органическая химия, пер. с англ., т. 2, М., 1982, с. 551-52; Уоринг А. Дж., там же, с. 594-99. Е.М. Pохлин.
