Перкова реакция
ПЕРКОВА РЕАКЦИЯ, получение виниловых эфиров к-т пятивалентного P взаимодействием a-галогенкарбонильных соед. с производными к-т трехвалентного P, содержащих по крайней мере одну алкоксильную группу:
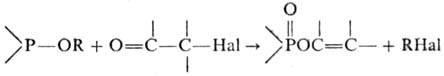
Р-цию проводят в углеводородах, спиртах, уксусной к-те или без р-рителя при т-рах от - 10 до 160 0C. Продукты р-ции обычно являются смесью цис- и транс-изомеров. В случае смешанных эфиров (RO)2POR' в виде алкилгалогенида отщепляется радикал с меньшей мол. массой. Реакц. способность фосфорной компоненты снижается в ряду:
R2POR' > RP(OR')2 > (RO)3P.
В Перкова реакцию вступают разл. a-галогенкарбонильные соед., в т. ч. производные a-галогенкарбоновых к-т и их тиоаналоги, напр.:
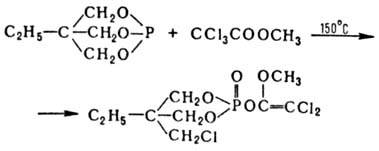
Реакц. способность карбонильных соед. снижается в ряду: Cl3CHO > CHCl2CHO > CH2ClCHO. В случае a-галогенкето-нов наряду с Перкова реакцией осуществляется Арбузова реакция. При этом преимуществ. протекание Перкова реакции в зависимости от природы галогена возрастает в ряду: I < Br < Cl, а также при увеличении числа a-атомов галогена, использовании р-рите-ля и снижении т-ры проведения р-ции. Р-ция Арбузова не идет в случае a-галогенальдегидов и протекает лишь в малой степени, если фосфорная компонента - фосфинит или фосфонит.
Для Перкова реакции предложено неск. механизмов. По одному из них предполагается образование промежут. фосфониевого соед. I:
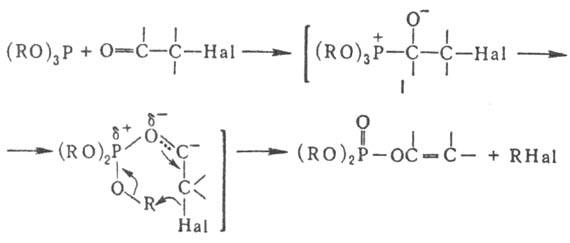
Перкова реакцию применяют в произ-ве инсектицидов, напр. дихлор-фоса (CH3O)2P(О)OCH=CCl2; непредельные эфиры к-т фосфора м. б. использованы в качестве мономеров.
Р-ция открыта В. Перковом в 1952.
Лит.. Владимирова И. Л.. Трапов А. Ф.. Ломакина В. И., в кн.: Реакции и Mетоды исследования органических соединений, кн. 16. M., 1966, с. 7-373. В. А. Гиляров.
