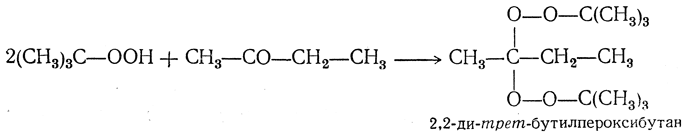IV. Реакции окисления
1. Образование карбоновых кислот Благодаря тому, что в альдегидах имеется атом водорода, связанный с карбонильной группой, альдегиды чрезвычайно легко окисляются не только разными окислителями, но даже и кислородом воздуха. Продуктами окисления обыкновенно являются кислоты, содержащие в молекуле то же число атомов углерода, что и исходные альдегиды:
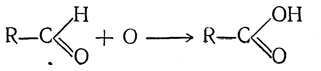
Для открытия альдегидов часто пользуются реакцией восстановления аммиачного раствора окиси серебра, причем серебро может выделяться на стенках стеклянного сосуда в виде зеркального слоя. Для этой же цели пользуются реакцией восстановления фелинговой жидкости; при этом из синего раствора осаждается при нагревании красный осадок закиси меди.
Кетоны окисляются значительно труднее альдегидов — только при действии сильных окислителей (например, KMnO4). При этом обыкновенно разрывается связь между карбонильной группой и одним из алкилов и получаются кислоты с меньшим числом атомов углерода в молекуле.
Реакция окисления кетонов может быть применена для определения их строения. Так как связь между углеродными атомами может разорваться с каждой стороны карбонильной группы (правила окисления кетонов А. Н. Попова), то в наиболее общем случае могут получиться четыре кислоты. Например, этилбутилкетон
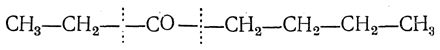
может дать следующие четыре кислоты:
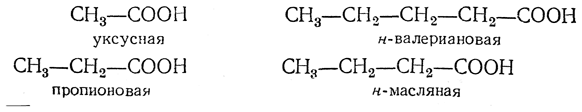
Фактически при окислении кетонов получаются не только ожидаемые согласно приведенной схеме кислоты, но и кислоты с меньшим числом атомов углерода. Это часто затрудняет установление строения исходного кетона.
2. Реакция Канниццаро В водных растворах альдегидов иногда удается наблюдать протекающую под влиянием щелочных агентов реакцию, очень характерную для ароматических альдегидов. Эта реакция, открытая Канниццаро, состоит в образовании из двух молекул альдегида молекулы спирта и молекулы соответствующей кислоты, например:
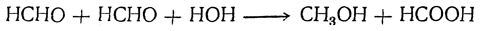
Однако в большинстве случаев этот процесс у алифатических альдегидов подавляется процессами конденсации, протекающими вплоть до образования смолистых веществ, а реакция Канниццаро лишь побочно сопровождает другие реакции, например альдольную конденсацию.
3. Реакция Тищенко Особая реакция, также являющаяся реакцией окисления одной молекулы альдегида в кислоту за счет восстановления другой в спирт, происходит при действии на альдегиды алкоголятов алюминия. При этом из двух молекул альдегида образуется одна молекула сложного эфира:
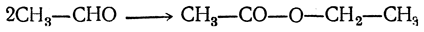
4. Реакция Меервейна—Понндорфа Безводные алкоголяты алюминия являются также катализаторами в сравнительно недавно открытой реакции Меервейна—Понндорфа. Она заключается в том, что в смеси высшего кетона с низшим вторичным спиртом, например с изопропиловым, в присутствии безводного алкоголята алюминия устанавливается равновесие:
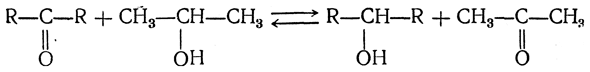
Если исходный кетон и оба вторичных спирта значительно менее летучи, чем ацетон, то, нагревая такую смесь, можно отогнать последний и тем самым сместить равновесие вправо. Применяя избыток изопропилового спирта, можно этим путем нацело восстановить весь исходный кетон.
Наоборот, действуя избытком ацетона на вторичный спирт в присутствии безводного изопропилата алюминия и отгоняя смесь образующегося изопропилового спирта с ацетоном, можно полностью превратить исходный спирт в кетон (Оппенауэр). Механизм этих реакций заключается в промежуточном образовании комплексов карбонильных соединений с алкоголятом алюминия:
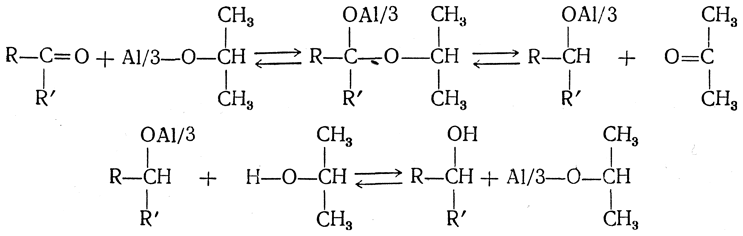
5. Образование перекисей При окислении кетонов, способных к енолизации, получаются α-гидроперекиси:
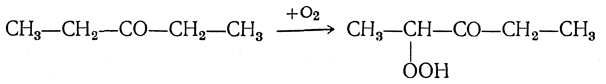
При действии на альдегиды и кетоны перекиси водорода получаются гидроперекиси оксиалкилов
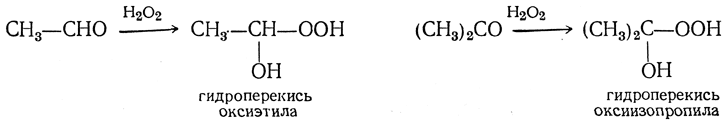
и перекиси бис-оксиалкилов:
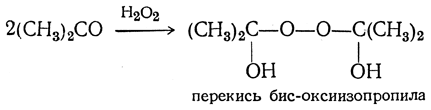
Иногда эти вещества самопроизвольно дегидратируются, образуя крайне взрывчатые димерные и тримерные циклические перекиси алкилиденов, например:
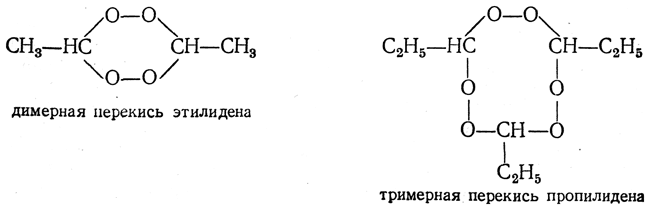
В присутствии минеральных кислот перекись водорода реагирует с альдегидами и кетонами несколько иначе, приводя к дигидроперекисям алкилов, например:
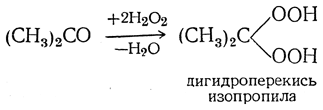
Органические гидроперекиси в присутствии минеральных кислот также реагируют с альдегидами и кетонами. При этом образуются диалкилпероксиалканы, например: