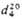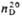Оксиальдегиды и оксикетоны
ОКСИАЛЬДЕГИДЫ И ОКСИКЕТОНЫ (гидроксиальде-гиды и гидроксикетоны), содержат в молекуле гидроксиль-ную и альдегидную или кетонную группы. В зависимости от взаимного расположения этих групп различают 1,2-оксиальдегид и оксикетон (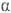 ), 1,3-оксиальдегид и оксикетон (
), 1,3-оксиальдегид и оксикетон ( ), 1,4-оксиальдегид и оксикетон (g) и т.д. Названия соед. производят, добавляя префикс "гидрокси" к названиям альдегидов и кетонов.
), 1,4-оксиальдегид и оксикетон (g) и т.д. Названия соед. производят, добавляя префикс "гидрокси" к названиям альдегидов и кетонов.
В природе оксиальдегиды и оксикетоны встречаются в своб. виде и в виде гликозидов. Так, салициловый альдегид найден в многолетних травах сем. розоцветных, в т.ч. в лабазнике; ванилин-в бобах ванили; 4-гидроксиацетофенон содержится в виде гликозида пицеина в иглах пихты и в коре ивы; ализарин -в виде гликозида в корнях марены красильной. В природе встречаются также производные оксинафтохинонов и окси-антрахинонов.
Оксиальдегиды и оксикетоны-жидкости или твердые в-ва (см. табл.), иногда окрашенные, хорошо раств. во многих орг. р-рителях. Низшие алифатические оксиальдегиды и оксикетоны раств. в воде, высшие алифатические и ароматические оксиальдегиды и оксикетоны в воде раств. с трудом.
В ИК спектрах характеристич. полосы поглощения группы СО, при отсутствии взаимного влияния гидроксильной и карбонильной групп, лежат в той же области, что и для соответствующих альдегидов и кетонов. При наличии внутримол. водородной связи полосы поглощения группы СО для алифатических оксиальдегидов и оксикетонов лежат в области 1550-1650см-1, для ароматических - эти полосы сдвинуты на 10-15 см-1 и лежат в области 1680-1700 см-1; для соед. с внутримол. водородной связью полосы еще более сдвинуты, напр. для салицилового альдегида 1666см-1.
Для оксиальдегидов и оксикетонов характерны общие р-ции альдегидов и кетонов. Специфич. св-ва оксиальдегидов и оксикетонов зависят от взаимного расположения гидроксильной и карбонильной групп.
1,2-Гидроксиальдегиды-сильные восстановители, с фенилгидразином дают озазоны, напр.: НОСН2СНО + 2C6H5NHNH2 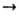 (C6H5NHN=CH)2
(C6H5NHN=CH)2
СВОЙСТВА НЕКОТОРЫХ ГИДРОКСИАЛЬДЕГИДОВ И ГИДРОКСИКЕТОНОВ
| Соединение | Название | Мол. м. | Т. пл., °С | Т. кип., оС/мм рт.ст. | | | ||
| НОСН2СНО | Гликолевый альдегид (гидроксиацетальдегид) | 60,052 | 97 | - | 1,366а | 1,4772б | ||
| НОСН2СН(ОН)СНОв | D-Глицериновый альдегид(О-2,3-дигидроксипропапаль) | 90,078 | 138,5 | - | - | - | ||
| D L-Глицериновый альдегид (рацемат) | | 145 | 140-150/0,8 | - | - | |||
| СН3СН(ОН)СН2СНО | Альдоль (3-гидроксибутаналь, 3-гидроксимасляный альдегид) | 88,106 | 0 | 83/20 | 1,1094г | 1,4238 | ||
| НСО(СН2)3СН(ОН)СНО | 2-Гидроксиадипиновый альдегид (2-гидроксигександиаль) | 130,143 | -3,5 | 37/50 | 1,066 | - | ||
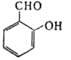
| | Салициловый альдегид (2-гидроксибензальдетид) | 122,123 | -7,0 | 197 | 1,1674 | 1,5740 | ||
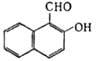
| | 2-Гидрокси- 1 -нафталинкарбальдегид | 172,182 | 84 | 192/27 | - | - | ||
| НОСН2СОСН3 | Ацетол (гидроксиацетон, 1 -гидрокси-2-пропанон) | 74,079 | -17 | 54/18 | 1,0824д | 1,4295 | ||
| НОСН2СОСН2ОН | Дигидроксиацетон (1 ,3-дигидрокси-2-пропанон) | 90,078 | 89-91,5 | - | - | - | ||
| СН3СОСН(ОН)СН3 | Ацетоин(3-гидрокси-2-бутанон) | 88,106 | - | 143 | 1,013 | 1,4135 | ||
| CH3COCH2C(OH)(CH3)2 | Диацетоновый спирт (4-гидрокси-4-метил-2-пентанон) | 116,164 | -44 | 164 | 0,9387 | 1,4213 | ||
| C6H5CH(OH)COC6H5 | 212,248 | 137 | 344 | 1,310 | - | |||
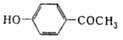
| | 4- Гидроксиацетофенон | 136,15 | 110,3 | 147-48 | 1,109е | 1,5577е | ||
а При 100°С. б При 19°С. в 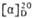 +14 (вода). г При 16°С. д Значение
+14 (вода). г При 16°С. д Значение 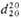 . е При 109°С.
. е При 109°С.
В твердом состоянии 1,2-гидроксиальдегиды, способные к енолизации, димеризуются; в р-ре наблюдается равновесие между пяти- и шестичленными циклич. димерами:
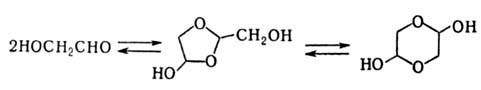
Аналогично ведут себя 1,2-гидроксикетоны. Под действием к-т 1,2-гидроксиальдегиды и 1,2-гидроксикетоны превращ. друг в друга, напр.:
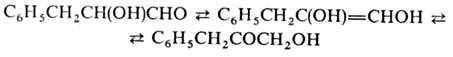
1.2-Гидроксиальдегиды с третичной группой ОН в присут. Сu(ОН)2 образуют карбоновую к-ту и 1,2-гидроксикетон:
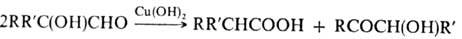
1.3-Гидроксиальдегиды (альдоли) также склонны к димеризации; напр., 3-гидроксибутаналь образует шести-членный циклич. димер:
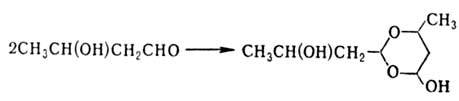
При нагр. в присут. к-т 1,3-гидроксиальдегиды дегидра-тируются, напр.:
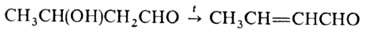
1,4 и 1,5-Гидроксиальдегиды находятся в равновесии со своими циклич. полуацеталями (лактолами):
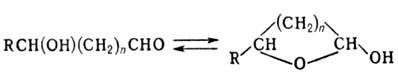
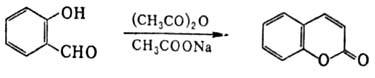
В ароматич. гидроксиальдегидах благодаря введению группы ОН реакц. способность группы СНО понижена. Так, 4-гидроксибензальдегид устойчив на воздухе в отличие от бензальдегида. Характерная особенность гидроксибензаль-дегидов и их производных-способность образовывать гете-роциклич. соед., напр.:
1,2-Гидроксикетоны (ацилоины) способны к кетоеноль-ной таутомерии и образованию хелатных соед.:
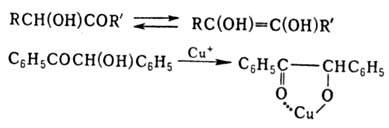
К 1,3-гидроксикетонам м. б. отнесен ацетилацетон, к-рый в нек-рых р-рителях содержит до 92% енольной формы, и гексафторацетилацетон, существующий исключительно в виде енола CF3C(OH)=CHCOCF3.
Оксиальдегиды и оксикетоны получают восстановлением дикарбонильных соед. (р-ции 1, 2) или эфиров дикарбоновых к-т (3), гидролизом галогенсодержащих карбонильных соед. (4), ацилоиновой (5), бензоиновой (6) или альдольной конденсацией (7):
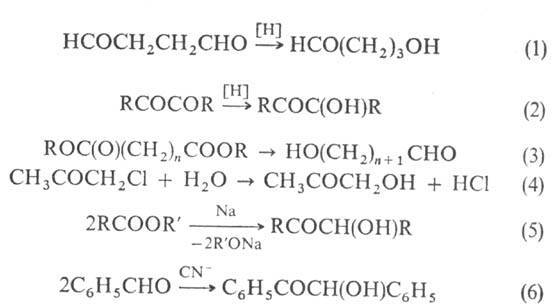
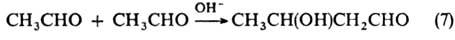
Ароматические оксиальдегиды и оксикетоны получают введением группы RCO в ароматич. цикл, напр. по р-циям Фриделя-Крафтса, Райме-ра-Тимана, Гаттермана, Гаттермана-Коха, Хеша, Фриса и Даффа.
Оксиальдегиды и оксикетоны используют для синтеза лек. и душистых в-в, в качестве фунгицидов, протравителей древесины, стабилизаторов для белков и полигидроксисоединений, реагентов в аналит. химии и др. Гидроксилсодержащие производные бензохинона, нафтохинона и антрахинона применяют в качестве красителей. О полигидроксиальдегидах и поли-гидроксикетонах см. Моносахариды.
Лит.: Бюлер К., Пирсон Д., Органические синтезы, пер. с англ., ч. 2, М., 1973; Роберте Д. Д., Касерио М. К.. Основы органической химии, пер. с англ., т. 2, М., 1978; Общая органическая химия, пер. с англ., т. 2, М., 1982; Темникова Т. И., Семенова С. Н., Молекулярные перегруппировки в органической химии, Л., 1983. С. К. Смирнов.