Моносахариды
МОНОСАХАРИДЫ, углеводы, представляющие собой по-лигидроксиальдегиды (альдозы) и полигидроксикетоны (ке-тозы) общей ф-лы СnН2nОn (п = 3-9), в к-рых каждый атом С (кроме карбонильного) связан с группой ОН, и производные этих соед., содержащие разл. др. функц. группы, а также атом Н вместо одного или неск. гидроксилов.
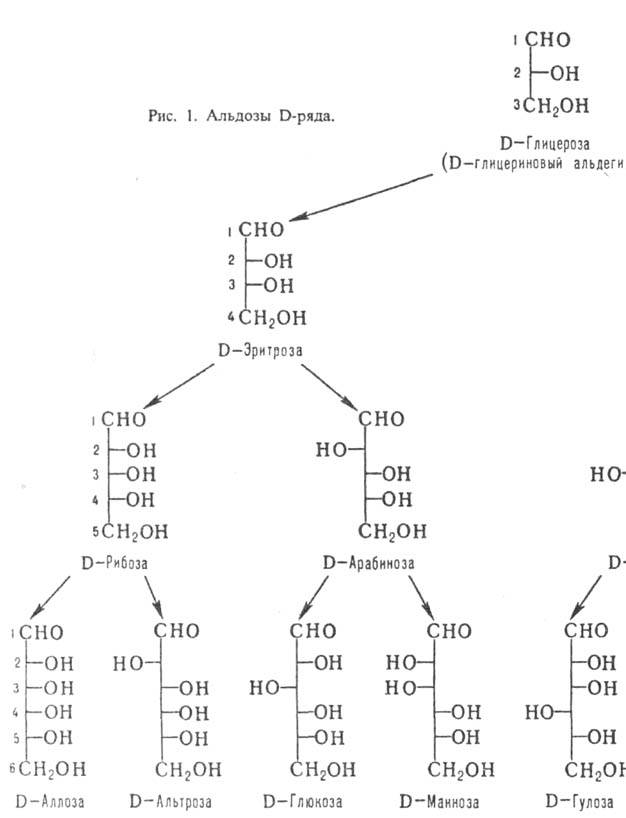
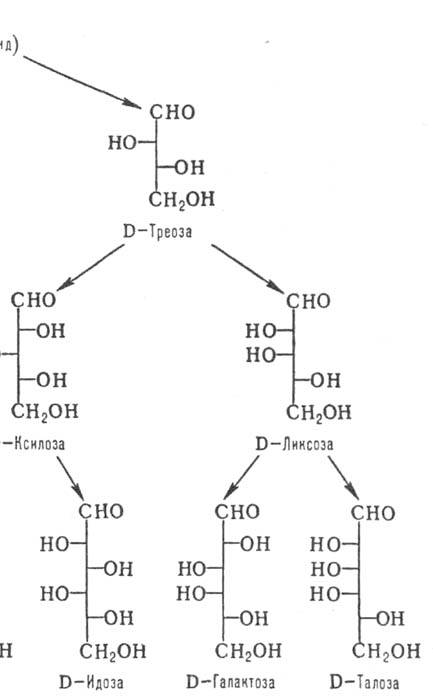
По числу атомов С различают низшие моносахариды (триозы и тетрозы; содержат в цепи соотв. 3 и 4 атома С), обычные (пентозы и гексозы) и высшие (гептозы, октозы, нонозы). Углеродные атомы в молекулах моносахаридов нумеруют таким образом, чтобы атом С карбонильной группы имел наим. номер (рис. 1 и 2).
Инголда - Прелога; ф-лы I и II). Другие моносахариды имеют неск. асим. атомов С; их рассматривают как производные D- или L-глицеринового альдегида и относят к D- или L-ряду (абс. конфигурация моносахаридов) в соответствии с конфигурацией предпоследнего (п — 1) атома С.
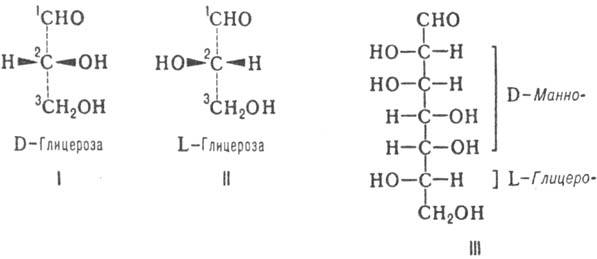
Различия между изомерными моносахаридами в каждом ряду обусловлены относит. конфигурацией остальных асим. центров; каждой относит. конфигурации в альдотетрозах, альдопен-тозах и альдогексозах соответствует тривиальное назв. мо-носахарида (рис. 1). Для обозначения конфигураций высших Сахаров используют префиксы, образованные из таких назв. (напр., L-глицеро-D-манно-гептоза; III). Стереохим. взаимоотношения между моносахаридами хорошо иллюстрируются проекционными Фишера формулами, в к-рых группа ОН располагается справа от вертикальной черты, обозначающей углеродную цепь, если соответствующий асим. центр имеет D-конфигу-рацию, и слева, если он имеет L-конфигурацию. Каждому представителю D-ряда соответствует его оптич. антипод, относящийся к L-ряду, в к-ром все асим. центры имеют противоположную конфигурацию. Общее число изомерных альдоз равно 2n, где п-число асим. атомов С в молекуле.
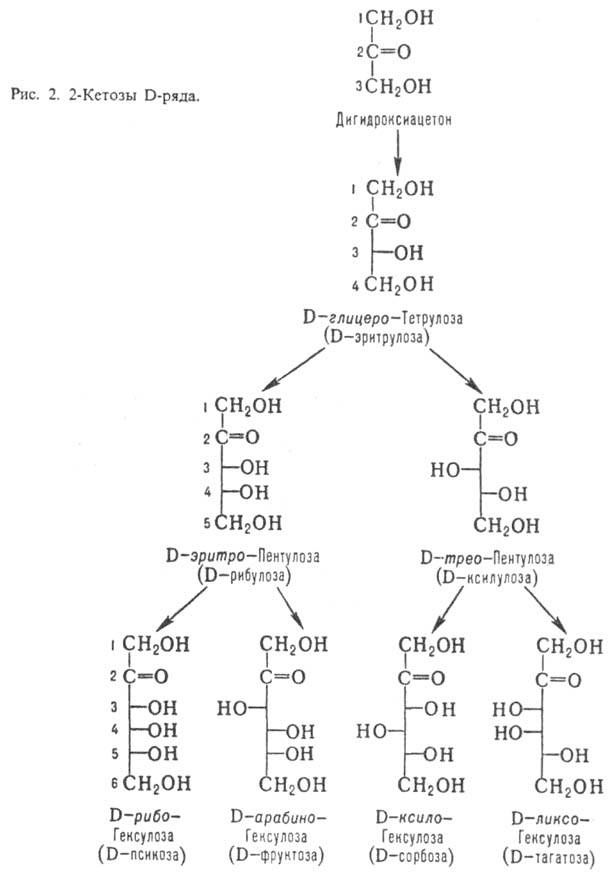
Кетозы по сравнению с альдозами с той же длиной углеродной цепи содержат на один асим. атом С меньше. Однако у них встречается еще один вид изомерии, обусловленный разл. положением карбонильной группы. У большинства прир. кетоз атом С карбонильной группы занимает положение 2; представители D-ряда таких кетоз показаны на рис. 2.
Карбонильные группы моносахаридов легко реагируют внутримолеку-лярно с группами ОН, образуя циклич. полуацетали. Последние могут представлять собой пятичленный (фураноз-ная форма) или шестичленный (пиранозная форма) цикл и отличаться конфигурацией образующегося на месте карбонильной группы нового асим. центра (атом С этого асим. центра наз. а н о м е р н ы м, или г л и к о з и д н ы м). Эту конфигурацию обозначают буквой а, если она совпадает с конфигурацией центра, определяющего принадлежность моносахарида к D- или L-ряду, и буквой Р в противоположном случае. Изомеры, различающиеся лишь конфигурацией аномерного атома, наз. а н о м е р а м и, а изменение конфигурации при этом атоме-а н о м е р и з а ц и е й. Для изображения циклич. форм моносахаридов удобно пользоваться Хоуорса формулами (см., напр., ф-лы IV и V-пиранозная и фуранозная формы кето-зы, а также рис. 3-циклич. ф-лы альдозы).

В р-ре каждый моносахарид находится в виде смеси таутомеров (напр., рис. 3), соотношение между к-рыми в состоянии равновесия определяется их термодинамич. устойчивостью; в большинстве случаев преобладают пиранозные формы, а ациклические присутствуют в следовых кол-вах. Напротив, моносахариды в кристаллич. состоянии представлены одной из тауто-мерных форм. Растворение кристаллов сопровождается таутомерными превращ., за протеканием к-рых можно следить по изменению во времени величины оптич. вращения (это явление наз. мутаротацией).
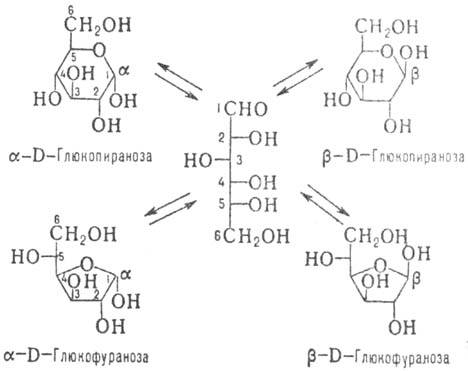
Рис. 3. Таутомерное равновесие D-глюкозы.
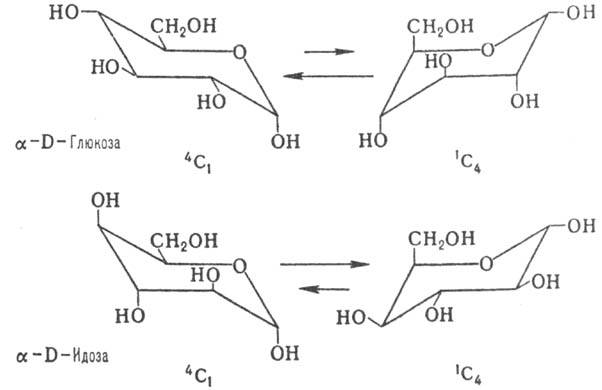
Фуранозные формы моносахаридов термодинамически менее выгодны, чем пиранозные, поскольку в практически плоском пятичленном цикле заместители вынуждены находиться в нестабильной заслоненной конформации. Напротив, шести-членные циклы имеют кресловидную форму, в к-рой заместители при соседних атомах С занимают более выгодные положения, соответствующие скошенной конформации. Существуют два типа кресловидной конформации пираноз-1С4 и 4C1 (цифры в верх. и ниж. индексах показывают номера атомов С, находящихся соотв. в верх. и ниж. положениях кресла). Более устойчивым является кресло с наим. числом объемистых аксиальных группировок. Поэтому для большинства альдогексоз D-ряда предпочтительным является кресло 4C1 с экваториальной группой СН2ОН и только для D-идозы в равновесии преобладает конформация 1С4 (влияние накопления аксильных групп ОН):
На относит. устойчивость a- и b-форм кроме пространств. факторов влияют диполь-дипольные взаимод.-аномерный эффект, в результате к-рого заместитель при аномерном атоме стремится занять аксиальное положение (особенно в малополярных р-рителях), и дельта2-эффект, заключающийся в повыш. нестабильности конформера с экваториальным заместителем у аномерного атома при наличии аксиального гидроксила в положении 2 (вследствие взаимного отталкивания атомов О; см. ф-лу Ньюмена):
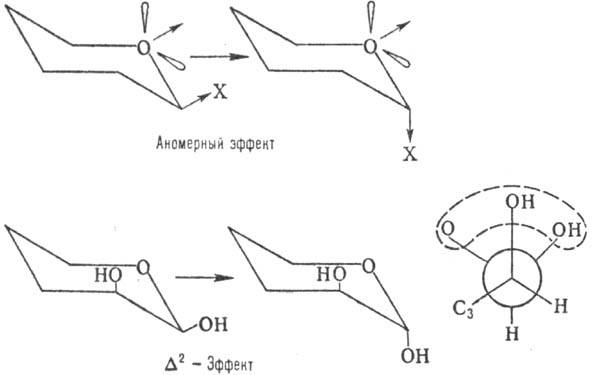
Кроме того, на относит. устойчивость a- и b-форм влияют водородные связи, к-рые могут играть стабилизирующую роль в относительно малополярных р-рителях, и нек-рые др. факторы.
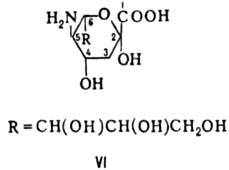
Кроме обычных известно неск. групп моносахаридов, отличающихся своеобразным набором функц. групп или структурой углеродной цепи. К ним относятся дезоксисахара (одна или неск. групп ОН замещены на атомы Н), аминосахара (одна или неск. групп ОН замещены на аминогруппы), урановые кислоты (группа СН2ОН окислена в карбоксильную), разветвленные сахара (имеют разветвленную углеродную цепь с ме-тильной, гидроксиметильной или альдегидной группой в качестве ответвлений), высшие 2-кето-З-дезоксиальдоновые к-ты, в т.ч. сиаловые к-ты - производные 2-кето-3,5-дидез-окси-5-амино-D-глицеро-D-галакто-нононовой (нейрамино-вой) к-ты (ф-ла VI).
Физические и химические свойства. Моносахариды-бесцв. кристаллич. в-ва, легко раств. в воде, ДМСО, трудно-в этаноле, не раств. в неполярных орг. р-рителях. Важнейшие физ.-хим. характеристики моносахаридов -уд. вращение, используемое наряду с хроматографич. методами для идентификации природных моносахаридов, и спектры ПМР, с помощью к-рых можно определить относит. конфигурацию моносахаридов. Для выяснения абс. конфигурации используют рентгеноструктурный анализ кристаллов или хим. трансформацию моносахаридов в более простые соед. с известной конфигурацией.
Хим. св-ва моносахаридов обусловлены наличием в их молекулах групп С=О (у ациклич. таутомера) и ОН. При действии NaBH4 в водном р-ре карбонильная группа моносахаридов количественно восстанавливается до спиртовой; образующиеся полиолы в виде летучих ацетатов или триметилсилиловых эфиров можно использовать для количеств. анализа смесей моносахаридов с помощью ГЖХ. Группы С=О альдоз в мягких условиях окисляются бромной водой с образованием лактонов альдо-новых к-т. Кетозы в эту р-цию не вступают и м. б. таким образом выделены из сложных смесей с альдозами. Определение "восстанавливающей способности" (т.е. окисление группы С=О) используют в многочисл. методиках анализа моносахаридов.
При действии оснований возможна енолизация группы С=О, сопровождающаяся изменением конфигурации соседнего асим. центра или миграцией карбонила (см. Лобри де Брюйна - ван Экенстейна реакция). В более жестких условиях происходят b-элиминирование заместителей и скелетные перегруппировки. При обработке к-тами в жестких условиях из пентоз образуется фурфурол, из гексоз - 5-гид-роксиметилфурфурол; конденсация последних с фенолами или ароматич. аминами с образованием окрашенных соед. лежит в основе разнообразных методик спектрофотометрич. определения моносахаридов.
Из р-ций группы С=О с азотистыми соед. большое историч. значение имела конденсация моносахаридов с фенилгидрази-ном, приводящая к фенилозазонам. Широко используется р-ция альдоз с NH2OH с послед. ацетилированием:
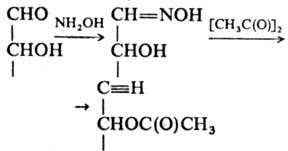
Образующиеся ацетилир. альдононитрилы удобны для анализа с использованием ГЖХ. Распад таких нитрилов под действием оснований служит для укорочения углеродной цепи моносахаридов на один атом, а присоединение HCN к карбонильной группе с послед. восстановлением нитрила в альдегид (Килиани - Фишера реакция) - для удлинения.
Из р-ций групп ОН широко используются образование простых и сложных эфиров, ацеталей, замещение на др. функцией, группировки, окисление и т. д. Метиловые эфиры (весьма прочные соед.) служат для постоянной защиты групп ОН в структурном анализе олиго- и полисахаридов. Бензиловые эфиры применяют для временной защиты групп ОН, поскольку эти группы легко удаляются гидрогено-лизом. Трифенилметиловые (тритиловые) эфиры удобны для избират. замещения первичных групп ОН в присут. вторичных. Ацетилирование широко применяют для временной неизбират. защиты всех групп ОН в молекуле моносахаридов, тогда как бензоилирование чаще используют для избират. замещения (первичные группы ОН реагируют легче вторичных, экваториальные легче аксильных). Омыление эфиров, образованных орг. к-тами, легко осуществляется обработкой метилатом Na в метаноле и приводит к исходным моносахаридам. Напротив, эфиры сульфокислот (тозилаты, мезилаты и трифлаты) применяют для активации соответствующей группы ОН при нуклеоф. замещении, в т.ч. с обращением конфигурации. Это позволяет осуществлять эпимеризацию (напр., при действии бензоата Na) у к.-л. атома С (т.е. переход от одного моносахарида к другому), замещение группы ОН на атом галогена, на др. функц. группы (синтез амино- и тиосахаров), получать внутримол. простые эфиры (ангид-росахара), ненасыщенные производные моносахаридов и т.д.
С альдегидами и кетонами моносахариды образуют циклич. ацетали, строение к-рых определяется природой исходного моносахарида и реагента (с альдегидами предпочтительно образуются шес-тичленные циклы, с кетонами -пятичленные); р-ция может сопровождаться таутомерными превращ. (знак ~ показывает, что моносахарид может иметь a- или b-конфигурацию), напр.:
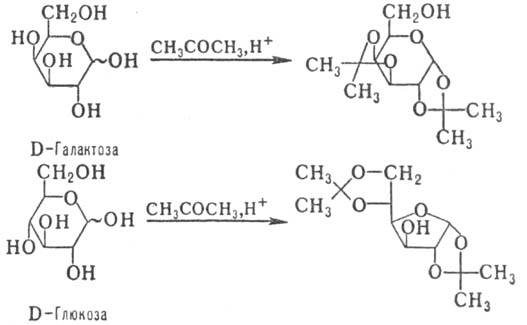
Ацетали устойчивы в щелочных и нейтральных средах; в присут. к-т гидролизуются, причем в ряде случаев возможно избират. удаление одной из двух присутствующих группировок, напр.:
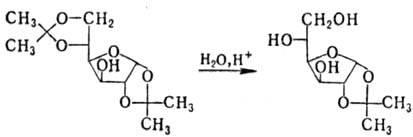
Комбинации перечисл. р-ций групп ОН (образование и гидролиз простых и сложных эфиров, получение ацеталей) позволяют синтезировать частично защищенные моносахариды с определенным расположением заместителей, что имеет важное значение в синтетич. химии моносахаридов.
Окисление защищенных моносахаридов, содержащих своб. первичную группу ОН, применяют для получения уроновых к-т, а содержащих своб. вторичную группу ОН-для получения карбонильных производных, широко используемых как про-межут. соед. в синтезе моносахаридов с новыми функц. группами, для разветвления углеродной цепи и для обращения конфигурации асим. центра при послед. восстановлении. Для анализа моносахаридов применяют специфич. окисление их йодной к-той и ее солями-т. наз. периодатное окисление (см. Малапрада реакция).
Гидроксил у аномерного атома С (его называют аномер-ным, гликозидным, или полуацетальным) значительно отличается от прочих групп ОН повыш. склонностью к р-циям нуклеоф. замещения. Его обмен на остатки спиртов приводит к образованию гликозидов. Если спиртовой компонентой гликозида (агликоном) служит др. молекула моносахарида, образуются олигосахариды и полисахариды. При кипячении моносахаридов с большим избытком низшего спирта в присут. к-т (метод Фишера) образуется смесь изомерных гликозидов, соответствующих разным таутомерным формам моносахаридов:
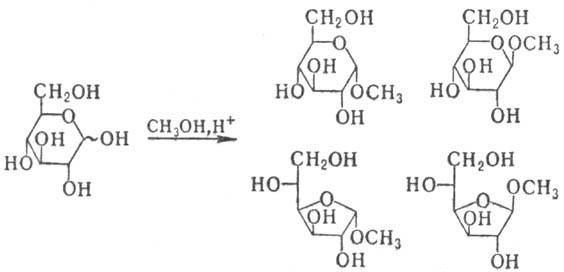
При разделении этой смеси получают индивидуальные гли-козиды, устойчивые в щелочных и нейтральных средах, а при нагр. с водными к-тами дающие исходный моносахарид. Получение таких гликозидов служит наиб. удобным и распространенным способом временной защиты карбонильной группы моносахаридов.
Для синтеза гликозидов со сложными агликонами применяют защищенные производные моносахаридов с фиксир. размером цикла, в к-рых гликозидный центр активирован введением подходящего заместителя (см., напр., Кёнигса-Кноppa реакция).
Распространение в природе. В природе широко распространены гексозы (D-глюкоза, D-галактоза, D-манноза, D-фруктоза) и пентозы (D-ксилоза, D-арабиноза, D-рибоза). Моносахариды редко в природе встречаются в своб. состоянии. Они входят в виде остатков в состав многочисл. гликозидов: олиго- и полисахаридов, более сложных биополимеров-гли-копротеинов, гликолипидов, нуклеиновых кислот и др. Исключение - D-глюкоза, содержащаяся в плазме крови и соках растений, и D-фруктоза, большие кол-ва к-рой имеются в меде и плодах нек-рых растений.
Образование моносахаридов в растениях связано с ассимиляцией ими СО2 и происходит в результате фотосинтеза. Молекула СО2 присоединяется к 1,5-дифосфату D-рибулозы в хлоро-пластах с участием фермента рибулозодифосфат-карбокси-лазы, а образующаяся в результате 3-фосфо-D-глицериновая к-та (ф-ла VII) путем дальнейшего восстановления и конденсаций дает D-глюкозу (см. Глюконеогенeз)или D-фруктозу; при этом регенерируется молекула рибулозодифосфата (цикл Кальвина):
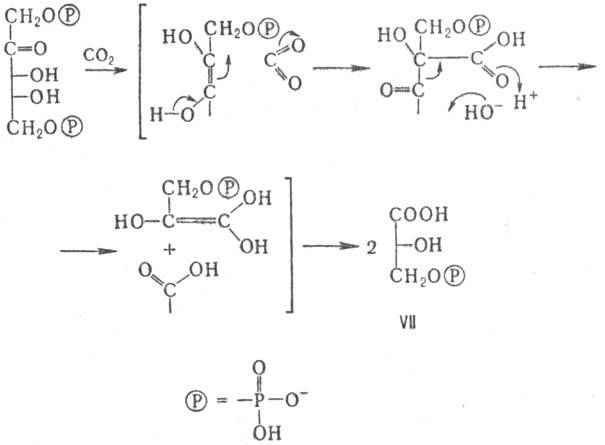
Распад гексоз, окислительный или анаэробный (гликолиз), служит источником энергии для большинства растит. и животных клеток; ферментативные трансформации гексоз приводят к получению др. природных моносахаридов, а при более глубоких превращ. в обмене веществ из них образуются аминокислоты, липиды и др. орг. соединения. В многочисл. р-ции окисления, гликозилирования, восстановления и эпи-меризации под действием соответствующих ферментов моносахариды вступают в виде нуклеозиддифосфатсахаров (НДФС). Так, напр., из уридиндифосфат-D-глюкозы (VIII) могут образовываться уридиндифосфат-D-галактоза (IX) и уридиндифос-фат-D-глюкуроновая к-та (X):
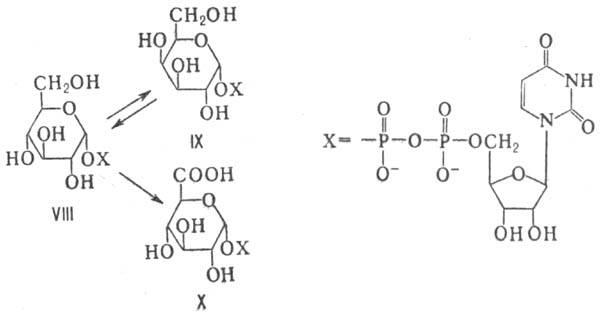
НДФС служат в живых клетках для построения гли-козидной связи; причем в зависимости от природы фермента, катализирующего гликозилирование, эта р-ция может сопровождаться как сохранением, так и обращением конфигурации аномерного атома С.
В биосинтезе углеводсодержащих биополимеров с участием мембранных ферментов в качестве доноров гликозиль-ных остатков выступают др. активированные производные моносахаридов, наделенные липофильными св-вами-полипренилмоно-или полилренолдифосфатсахара; напр., бактопренол-11-ди-фосфатглюкоза (XI)
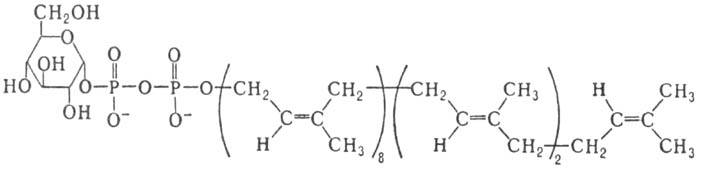 XI
XI
Получение и применение. Моносахариды получают кислотным гидролизом полисахаридов (напр., D-глюкозу-из крахмала, D-ксилозу-из богатых ксиланами отходов переработки с.-х. растений и древесины). Смесь глюкозы с фруктозой получают гидролизом сахарозы и используют в пищ. промети. D-Глюкоза находит применение в медицине. Восстановление D-глюкозы в D-сорбит и D-ксилозы в ксилит осуществляют в пром. масштабах водородом над никелевым катализатором. D-Сорбит служит исходным соед. в синтезе аскорбиновой к-ты (см. Витамин С)и наряду с ксилитом используется как обладающий сладким вкусом заменитель сахарозы при заболевании диабетом. Разнообразные моносахариды часто служат удобными хиральными исходными в-вами в синтезе сложных прир. соед. неуглеводной природы.
Исп. литература для статьи «МОНОСАХАРИДЫ»: Химия углеводов, пер. с англ., М., 1967; Стоддарт Дж., Стереохимия углеводов, пер. с англ., М., 1975; Степаненко Б. Н., Химия и биохимия углеводов. Моносахариды, М., 1977; Общая органическая химия, пер. с англ., т. 11, М., 1986, с. 127-202; Khadem Hassan S. El., Carbohydrate chemistry. Monosaccharides and their oligomers, San Diego, 1988. А. И. Усов.
