Классификация углеводов
Углеводы можно определить как альдегидные или кетонные производные полиатомных (содержащих более одной ОН-группы) спиртов или как соединения, при гидролизе которых образуются эти производные.
Согласно принятой в настоящее время классификации, углеводы подразделяются на три основные группы: моносахариды, олигосахариды и полисахариды.
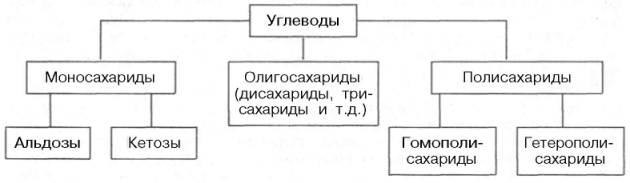
МОНОСАХАРИДЫ
Моносахариды можно рассматривать как производные многоатомных спиртов, содержащие карбонильную (альдегидную или кетонную) группу. Если карбонильная группа находится в конце цепи, то моносахарид представляет собой альдегид и называется альдозой; при любом другом положении этой группы моносахарид является кетоном и называется кетозой.
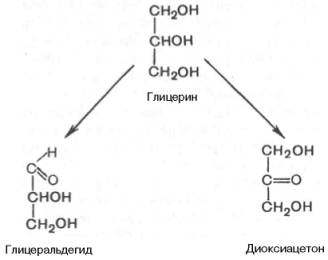
Простейшие представители моносахаридов – триозы: глицеральдегид и диоксиацетон. При окислении первичной спиртовой группы трехатомного спирта – глицерола – образуется глицеральдегид (альдоза), а окисление вторичной спиртовой группы приводит к образованию диоксиацетона (кетоза).
Стереоизомерия моносахаридов. Все моносахариды содержат асимметричные атомы углерода: альдотриозы – один центр асимметрии, альдо-тетрозы – 2, альдопентозы – 3, альдогексозы – 4 и т.д. Кетозы содержат на один асимметричный атом меньше, чем альдозы с тем же числом углеродных атомов. Следовательно, кетотриоза диоксиацетон не содержит асимметричных атомов углерода. Все остальные моносахариды могут существовать в виде различных стереоизомеров.
Общее число стереоизомеров для любого моносахарида выражается формулой N = 2n, где N – число стереоизомеров, а n – число асимметричных атомов углерода. Как отмечалось, глицеральдегид содержит только один асимметричный атом углерода и поэтому может существовать в виде двух различных стереоизомеров.
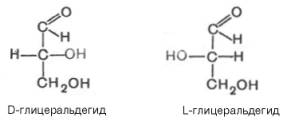
Изомер глицеральдегида, у которого при проекции модели на плоскость ОН-группа у асимметричного атома углерода расположена с правой стороны, принято считать D-глицеральдегидом, а зеркальное отражение – L-глицеральдегидом:
Альдогексозы содержат четыре асимметричных атома углерода и могут существовать в виде 16 стереоизомеров (24), представителем которых является, например, глюкоза. Для альдопентоз и альдотетроз число сте-реоизомеров равно соответственно 23 = 8 и 22 = 4.
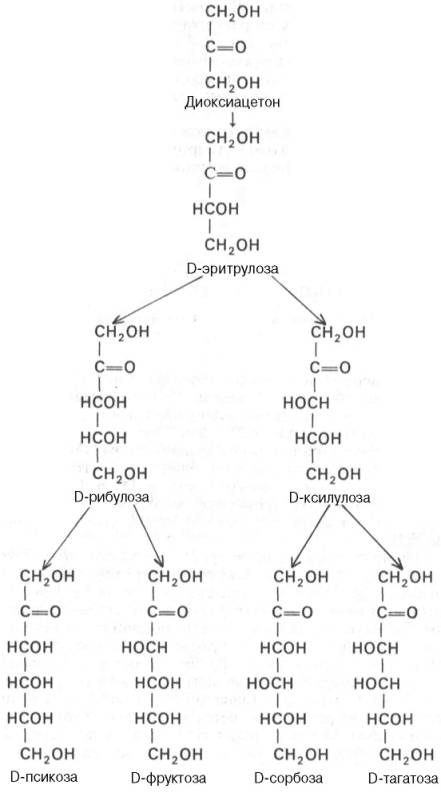
Все изомеры моносахаридов подразделяются на D- и L-формы (D-и L-конфигурация) по сходству расположения групп атомов у последнего центра асимметрии с расположением групп у D- и L-глицеральдегида. Природные гексозы: глюкоза, фруктоза, манноза и галактоза – принадлежат, как правило, по стереохимической конфигурации к соединениям D-ряда (схема 5.1).
Известно, что природные моносахариды обладают оптической активностью. Способность вращать плоскость поляризованного луча света – одна из важнейших особенностей веществ (в том числе моносахаридов), молекулы которых имеют асимметричный атом углерода или асимметричны в целом. Свойство вращать плоскость поляризованного луча вправо обозначают знаком плюс (+), а в противоположную сторону – знаком минус (–). Так, D-глицеральдегид вращает плоскость поляризованного луча вправо, т. е. D-глицеральдегид является D(+)-альдотриозой, а L-гли-церальдегид – L(–)-альдотриозой. Однако направление угла вращения поляризованного луча, которое определяется асимметрией молекулы в целом, заранее непредсказуемо. Моносахариды, относящиеся по стереохимической конфигурации к D-ряду, могут быть левовращающими. Так, обычная форма глюкозы, встречающаяся в природе, является правовращающей, а обычная форма фруктозы – левовращающей.
Циклические (полуацетальные) формы моносахаридов. Любой моносахарид с конкретными физическими свойствами (температура плавления, растворимость и т.д.) характеризуется специфической величиной удельного вращения [α]D20.
Схема 5.1 СЕМЕЙСТВО D-KETОЗ, СОДЕРЖАЩИХ 3-6 АТОМОВ УГЛЕРОДА
Явление мутаротации имеет объяснение. Известно, что альдегиды и кетоны легко и обратимо реагируют с эквимолярным количеством спирта с образованием полуацеталей:
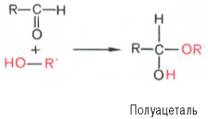
Реакция образования полуацеталя возможна и в пределах одной молекулы, если это не связано с пространственными ограничениями. По теории А. Байера, внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов. При образовании полуацеталей возникает новый асимметрический центр (для D-глюкозы это С-1). Шестичленные кольца сахаров называют пиранозами, а пятичленные – фуранозами. α-Форма – это форма, у которой расположение полуацетального гидроксила такое же, как у асимметричного углеродного атома, определяющего принадлежность к D- или L-ряду. Иными словами, в формулах с α-моди-фикацией моносахаридов D-ряда полуацетальный гидроксил пишут справа, а в формулах представителей L-ряда – слева. При написании β-формы поступают наоборот.
Таким образом, явление мутаротации связано с тем, что каждый твердый препарат углеводов представляет собой какую-либо одну циклическую (полуацетальную) форму, но при растворении и стоянии растворов эта форма через альдегидную превращается в другие таутомерные циклические формы до достижения состояния равновесия. При этом значение удельного вращения, характерное для исходной циклической формы, постепенно меняется. Наконец, устанавливается постоянное удельное вращение, которое характерно для равновесной смеси таутомеров. Например, известно, что в водных растворах глюкоза находится главным образом в виде α- и β-глюкопираноз, в меньшей степени – в виде α- и β-глюкофураноз и совсем небольшое количество глюкозы – в виде альдегидной формы.
Следует подчеркнуть, что из различных таутомерных форм глюкозы в свободном состоянии известны лишь α- и β-пиранозы. Существование малых количеств фураноз и альдегидной формы в растворах доказано, но в свободном состоянии они не могут быть выделены вследствие своей неустойчивости.
Установлено, что величина удельного вращения при растворении любого моносахарида постепенно меняется и лишь при дли тельном стоянии раствора достигает вполне определенного значения. Например, для свежеприготовленного раствора глюкозы [α]D20= +112,2°, после длительного стояния раствора эта величина достигает равновесного значения [α]D20= +52,5°. Изменение величины удельного вращения при стоянии (во времени) растворов моносахаридов называется мутаротацией. Очевидно, мутаротация должна вызываться изменением асимметрии молекулы, а следовательно, трансформацией ее структуры в растворе.
В 20-х годах У. Хеуорс предложил более совершенный способ написания структурных формул углеводов. Формулы Хеуорса – шести- или пятиугольники, причем они изображены в перспективе: кольцо лежит в горизонтальной плоскости. Находящиеся ближе к читателю связи изображают более жирными линиями (углеродные атомы цикла не пишут). Заместители, расположенные справа от остова молекулы при ее вертикальном изображении, помещают ниже плоскости кольца, а заместители, находящиеся слева,– выше плоскости кольца. Обратное правило применяют только для того единственного углеродного атома, гидроксильная группа которого участвует в образовании циклического полуацеталя. Так, у D-сахаров группу СН2ОН пишут над этим атомом углерода, а водородный атом при нем – внизу.
Наконец, следует помнить, что при написании структурных формул по Хеуорсу гидроксильная группа при С-1 должна быть расположена ниже плоскости кольца в α-форме и выше – в β-форме:
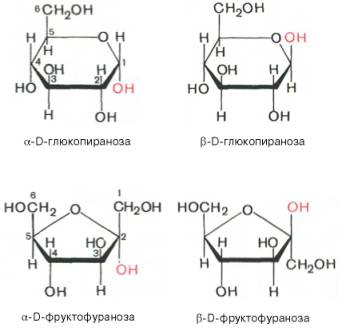
Проекционные формулы Хеуорса не отражают подлинной конформации моносахаридов. Подобно циклогексану, пиранозное кольцо может принимать две конфигурации – форму кресла и форму лодки (конформацион-ные формулы). Форма кресла обычно более устойчива, и, по-видимому, именно она преобладает в большей части природных сахаров (рис. 5.1).


