Углеводы
Углеводы (сахара) — группа природных полигидроксиальдегидов и полигидроксикетонов с общей формулой (CH2O)n. Группа включает простые сахара (моносахариды) и их высокомолекулярные аналоги, олигосахариды и полисахариды.
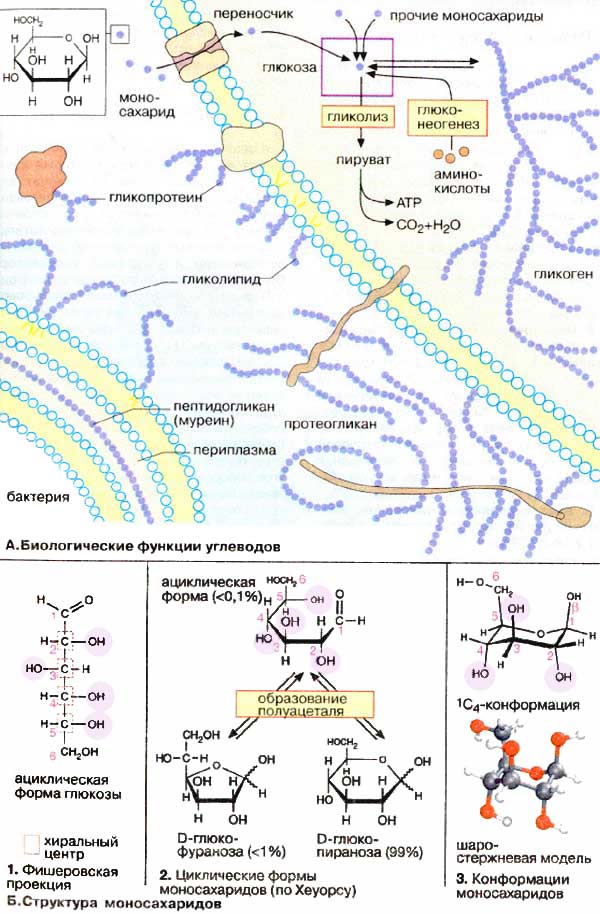
А. Биологические функции углеводов
Полисахариды, прежде всего крахмал и некоторые дисахариды, являются важными (хотя и не жизненно необходимыми) компонентами питания (см. с. 348). В кишечнике они расщепляются до моносахаридов, которые затем всасываются слизистой кишечника. Транспортной формой углеводов в крови позвоночных является глюкоза. Глюкоза поступает в клетки, где используется в качестве клеточного "топлива" (гликолиз) или превращается в другие метаболиты. Гликоген откладывается в некоторых органах (печень, мышцы) в качестве резервного полисахарида. Полисахариды служат строительным материалом для многих организмов. Так, в клеточных стенках бактерий в качестве стабилизирующего структурного компонента присутствует муреин (см. с. 46). В растениях эту функцию выполняют целлюлоза и другие полисахариды. Олигомерные и полимерные углеводы часто встречаются в ковалентно связанном виде с липидами (гликолипиды) или белками (гликопротеины), входящими в состав клеточных мембран. Растворимые гликопротеины присутствуют в плазме крови, а также входят в состав протеогликанов, которые являются важными структурными компонентами межклеточного матрикса.
Важнейший природный моносахарид, D-глюкоза, является алифатическим альдегидом, содержащим шесть углеродных атомов, пять из которых имеют гидроксильные группы (1). Поскольку атомы С-2 — С-5 являются хиральными центрами, кроме D-глюкозы существует 15 изомерных альдогексоз, лишь немногие из которых встречаются в природе. У большинства природных моносахаридов С-5 имеет конфигурацию D-глицеринового альдегида.
В нейтральном растворе менее 0,1% молекул глюкозы находятся в ациклической форме (1), Подавляющая часть глюкозы присутствует в форме циклического полуацеталя (2), образованного в результате взаимодействия карбонильной группы с одной из гидроксильных групп. В альдогексозах реакция идет главным образом по гидроксильной группе С-5 с образованием шестичленного пиранового цикла. Сахара с шестичленным циклом называются пиранозами. Замыкание кольца с участием гидроксильной группы С-4 дает фурановый цикл, а сахара с таким циклом называются фуранозами. В растворе все три формы, пиранозная, фуранозная и ациклическая находятся в динамическом равновесии.
Циклические формы моносахаридов принято изображать в виде проекционных формул (2), где цикл представлен в перспективе (проекции Хеуорса) Заместители при хиральных атомах углерода располагаются над или под плоскостью кольца в зависимости от их конфигурации. ОН-Группы, которые в фишеровской проекции (1) находятся справа, в проекции Хеуорса располагаются под плоскостью кольца, а группы, находящиеся слева, — над плоскостью кольца.
При образовании полуацеталей в молекуле появляется дополнительный асимметрический центр С-1, что делает возможным существование двух стерео изомеров. Соответствующие связи на схеме указаны волнистыми линиями.
В проекциях Хеуорса не учитывается тот факт, что в действительности пиранозный цикл не плоский, а имеет форму кресла. В представленной на схеме конформации D-глюкопиранозы (1С4-конформация, 3) большинство OH-гpyпп (как и в проекции Хеуорса) располагаются перпендикулярно плоскости кольца (аксиально, а-положение). Единственное исключение составляет полуацетальная ОН-группа при С-1, которая занимает экваториальное (е) положение.


