Окислительно-восстановительные процессы
А. Окислительно-восстановительные реакции
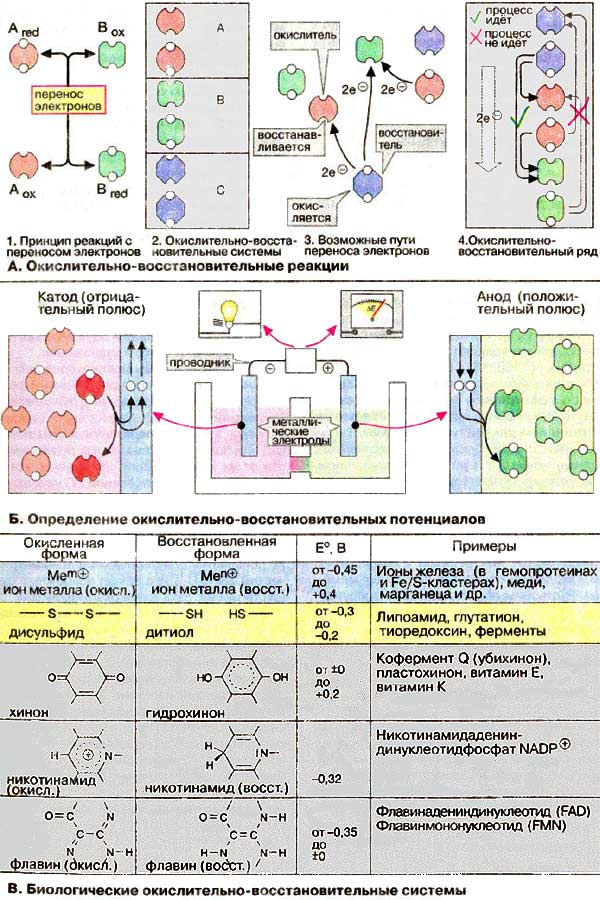
Окислительно-восстановительными (или редокc-реакциями) называются реакции, сопровождающиеся переносом электронов от донора к акцептору (1). По аналогии с кислотно-основными реакциями взаимодействующие вещества образуют сопряженные пары, которые принято называть окислительно-восстановительными парами (редокс-парами от англ, Redoxpara, Redoxsystem, 2). Оба компонента редокс-пары различаются числом электронов. Богатый электронами компонент называется восстановленной формой, а бедный электронами - окисленной формой соответствующего соединения. В ходе редокс-реакции восстановленная форма одной редокс-пары (восстановитель) переносит электроны на окисленную форму (окислитель) другой пары. При этом восстановитель окисляется, а окислитель восстанавливается (3). Любой восстановитель эффективен лишь в определенных реакциях. На основании таких наблюдений можно построить окислительно-восстановительный ряд (4).
Б. Определение окислительно-восстановительных потенциалов
Положение редокс-пары в ряду определяется окислительно-восстановительным потенциалом. Последний определяют с помощью электрохимической ячейки, которая позволяет оценивать перенос электронов между двумя редокс-парами, находящимися в разных сосудах. Прохождение электрического тока в результате переноса электронов между двумя химическими частицами, находящимися в разных сосудах, осуществляется через проводник, т. е. химическая энергия трансформируется в электрическую.
В цепь встроен высокоомный вольтметр, исключающий прохождение электрического тока. Измеряют не ток, а электрическое напряжение, которое соответствует разности электрического потенциала ΔE двух растворов. Восстановительный потенциал системы определяется как э.д.с. в вольтах (В), измеренная против известного потенциала, возникающего в стандартном полуэлементе (полуячейке). В качестве стандарта принят восстановительный потенциал системы 2Н+/Н2 ("водородный электрод"), который при определенных условиях условно считают равным нулю. Измеренный относительно стандарта потенциал конкретной окислительно-восстановительной пары может иметь знак плюс или знак минус. Величина E зависит от концентрации реагентов и условий проведения реакции. Поэтому вводят понятие стандартный окислительно-восстановительный потенциал (или восстановительный потенциал Ео, поскольку он характеризует реакцию восстановления), который определяют как потенциал восстановления данном редокс-пары в стандартных условиях и при равных концентрациях всех реагентов, а также Ео', определяемый как Ео при pH 7. Если пары расположить в порядке возрастания их восстановительных потенциалов, то получим электрохимический ряд напряжений (4). Спонтанный перенос электрона возможен лишь в том случае, если восстановительный потенциал вещества, которое должно отдавать электроны. — величина более отрицательная по сравнению с потенциалом вещества, которое должно принимать электроны.
В. Биологические окислительно-восстановительные пары
На схеме приведены окислительно-восстановительные реакции, наиболее часто встречающиеся в биологических системах. Стандартные восстановительные потенциалы (Б) соответствующих редокс-пар лежат в диапазоне от -0,45 до +0,4 В. В действительности потенциалы зависят от окружения к белке.
Многие окислительно-восстановительные реакции катализируются ферментами, содержащими в активном центре ионы металлов. Поскольку такие металлы необходимы в небольших количествах, их относят к так называемым следовым элементам. Ионы металлов образуют комплексы с боковыми функциональными группами аминокислотных остатков или входят в состав кофакторов (простетических групп). Так, ионы железа (Fe) присутствуют в Fe/S-центрах или входят в состав гема, причем атом железа может находиться в разной степени окисления от +4 до +2. Другими металлами, участвующими в редокс-реакциях, могyт быть медь (в форме Cu2+/ Cu+, см. с. 144), марганец и молибден.
Из органических веществ в окислительно-восстановительных реакциях часто участвуют тиоспирты (тиолы) и соответствующие дисульфиды. К этой группе относятся, например, редокс-пара цистеин/цистин, липоамид и глутатион.
Пара хинон/гидрохинон интегрируется в цепь переноса электронов (кофермент Q, см. с. 142), служит коферментом (витамин К, см. с. 352) или выполняет функции антиоксиданта, защищая клетки от действия окислителей.
К органическим редокс-парам относятся также пиридиннуклеотид- и флавинсодержащие коферменты (см. сс. 86, 102 и 108).


