Лактатдегидрогеназа: структура
В этом разделе в качестве примера взаимосвязи структуры и функции фермента более подробно рассмотрена лактатдегидрогеназа [ЛДГ (LDH), КФ 1.1.1.27].
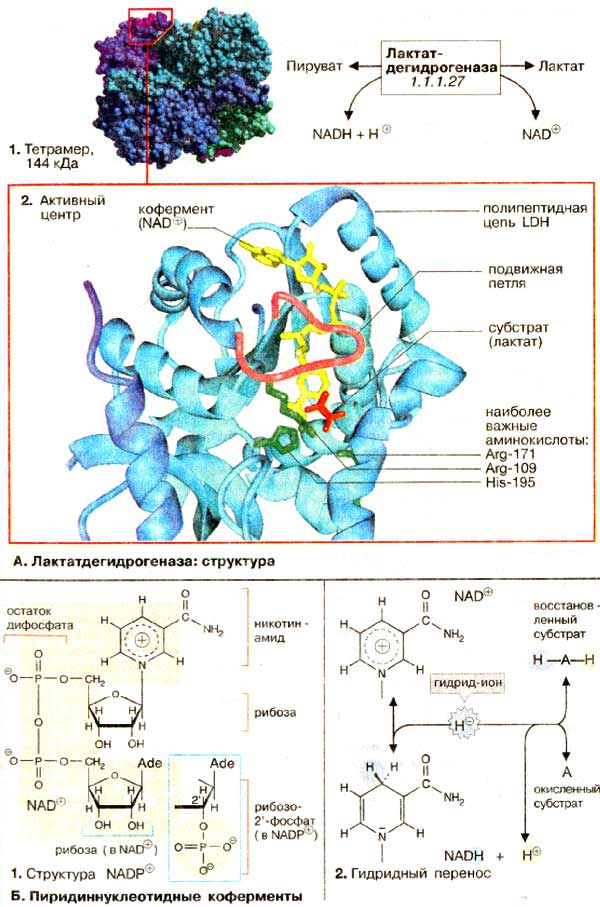
А. Лактатдегидрогеназа: структура
Активной формой лактатдегидрогеназы (молекулярная масса 144 кДа) является тетрамер из 4 субъединиц (1) Каждая субъединица образована пептидной цепью из 334 аминокислот (36 кДа). В тетрамере субъединицы занимают эквивалентные положения (1); каждый мономер содержит активный центр.
В организме млекопитающих имеются два различных типа субъединиц ЛДГ (H и M), незначительно различающиеся по аминокислотной последовательности; они могут ассоциировать в тетрамер случайным образом. Поэтому известно 5 различных изоферментов ЛДГ. В мышце сердца содержатся преимущественно тетрамеры, состоящие из Н-субъединиц (H от англ. heart), в ЛДГ печени и скелетных мышц преобладают М-мономеры.
Активный центр в субъединице ЛДГ схематически показан на рис. 2. При этом пептидный остов белка изображен в виде ленты (светло-голубой), дополнительно представлены молекулы: субстрата — лактата (красного цвета), кофермента НАД+ (желтого цвета) и три боковые цепи аминокислот (зеленого цвета), которые участвуют непосредственно в катализе. Кроме того, выделена пептидная петля (малинового цвета), образованная аминокислотными остатками 98-111. В отсутствие субстрата и кофермента эта структура раскрыта, что обеспечивает свободный доступ к субстратсвязывающему участку (не показано). На рисунке представлен блокированный активный центр в комплексе фермент-лактат-НАД+. Детали каталитического цикла лактатдегидрогеназы обсуждаются в следующем разделе.
Б. Пиридиннуклеотидные коферменты
Все дегидрогеназы нуждаются в коферменте для переноса восстановительных эквивалентов. Наиболее широко распространены коферменты динуклеотидного типа, в котором два нуклеозид-5'-монофосфата соединены фосфоангидридной связью. ЛДГ и многие другие дегидрогеназы нуждаются в никотинамидадениндинуклеотиде, сокращенно НАД+ (NAD+) (1). Обе нуклеотидных группы НАД+ построены из 5'-АМФ и нуклеотида, содержащего в качестве основания амид никотиновой кислоты. Структурно (но не функционально) похожим коферментом является НАДФ+ (NADP+), в котором 2'-ОН-группы рибозы аденина дополнительно связаны с фосфатом. Несмотря на близкое структурное родство НАД+ и НАДФ+ осуществляют различные функции в обмене веществ.
В окислительно-восстановительных реакциях пиридиннуклеотидного кофермента участвует только никотинамидное кольцо (2). Никотинамид является амидом пиридин-3-карбоновой (никотиновой) кислоты. В окисленной форме кольцо имеет ароматический характер и несет положительный заряд. По этой причине кофермент в окисленном состоянии обозначают как НАД+. При окислении лактата дегидрогеназа отщепляет от субстрата (AH2) два атома водорода [т. е. два электрона и два протона (2, середина)]. Однако на НАД+ переносится только гидрид-ион (H-, два электрона и один протон). Акцептором гидрид-иона является атом углерода в пара-положении к атому азота кольца НАД+. В этом месте образуется алифатическая СН2-группа, перестраиваются двойные связи кольца и исчезает положительный заряд (2, внизу). При окислении или восстановлении никотинамидного кольца изменяются также спектральные характеристики кофермента. Поэтому за реакцией можно легко следить фотометрически.
Второй протон высвобождается в среду и, следовательно, правильное наименование восстановленной формы кофермента NADH + H+, а не NADH2.


